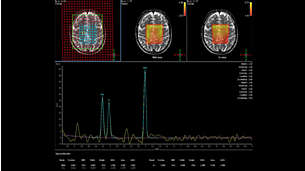
МРС – это уникальный метод, позволяющий измерять относительные концентрации ряда важнейших метаболитов посредствам получения и анализа МР-спектров”.
Ахадов Толибджон Абдуллаевич
Заслуженный врач Российской Федерации, профессор, доктор медицинских наук, заведующий отделением лучевой диагностики НИИ Неотложной Детской Хирургии и Травматологии
Получение структурных изображений не исчерпывает всего спектра задач, которые могут быть решены с помощью МР-томографа. Одной из методик, выходящих за рамки рутинных клинических применений МРТ, является протонная магнитно-резонансная спектроскопия (1H-МРС). МРС – это уникальный метод, позволяющий измерять относительные концентрации ряда важнейших метаболитов посредствам получения и анализа МР-спектров. В этом обзоре будут освещены базовые физические основы этого метода, принципы основных МР-последовательностей, использующиеся в МРС, а также основные клинические перспективы метода.
Физические основы МРС: химический сдвиг
Результатом МРС сканирования является не изображение, а спектр. Он представляет собой распределение интенсивности сигнала протонов по их резонансным частотам, выраженным в терминах химического сдвига. Химический сдвиг, т.е. положение сигнала протона в спектре, определяется разностью резонансных частот данного протона и протонов в составе молекулы принятой за стандарт (тетрометилсилан). Если размерностью интенсивность сигнала обычно являются относительные единицы (или arbitrary units (a.u.)), то в случае химического сдвига подходящей размерность были бы Герцы [Гц]. Однако, разница резонансных частот, которой и является химический сдвиг, проявляется лишь в 10-6 порядке [Гц], поэтому за размерность химического сдвига приняты миллионные доли [Гц], м.д. (или pars per million (ppm)). На рис.1. представлен типичный МР-спектр мозга человека, методы его получения и роль веществ, которые он характеризует, будут описаны ниже. По этому спектру (рис.1) мы видим, что сигналы протонов, находящихся в различных группах и веществах, отличаются не только по своей интенсивности, но и имеют различный химический сдвиг. Из вышесказанного следует, что разница в химическом сдвиге напрямую связана с разницей в резонансных частотах этих протонов. Однако остается вопрос, почему все протоны не резонируют на одной и той же частоте и почему возникает эта разница, не связанная с действием градиентных полей томографа или каких-либо других умышленных действий с нашей стороны?
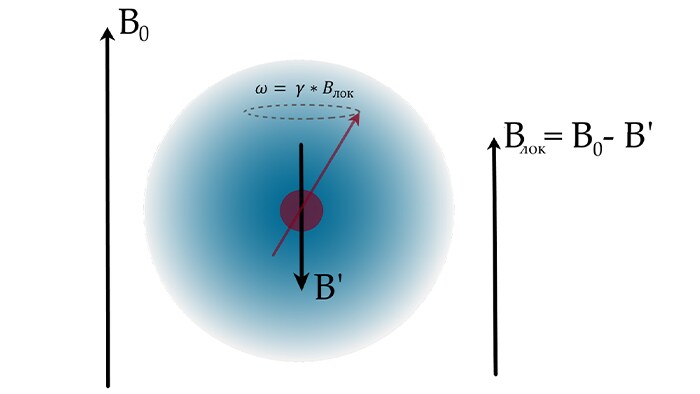
Причина в том, что в реальных условиях резонирующие протоны являются составной частью атомов и молекул. Рассмотрим простейший случай - протон в ядре свободного атома водорода. В этом случае, при помещении этого атома в магнитное поле B0, возникнет циркуляция электронного облака, окружающего ядро (в случае атома водорода – это сферическая 1s орбиталь). Такое движение электронов будет эквивалентно возникновению тока, причем направленного так, чтобы создаваемое им магнитное поле B’ ослабляло бы поле B0. Этот принцип называется законом Ленца и широко известен нам на примере катушки с током. Таким образом, ядро будет находится в локальном магнитном моле, отличном от B0: Bлок = B0(1 – σ), где σ – константа экранирования. Поскольку частота прецессии ядра напрямую зависит от индукции внешнего магнитного поля согласно закону Лармора ω = γ*Bлок, то резонансная частота протона также изменится. В молекулах ситуация усложняется: приходится учитывать перераспределение электронного облака и экранирование от других атомов в молекуле. Как правило, искажение сферической орбитали ведет к уменьшению вклада индуцированного поля и создает парамагнитную составляющую σпара, добавляющуюся к рассмотренному диамагнитному эффекту σдиа. Вклад в экранирование от других атомов можно учесть как добавку σ’. Таким образом константа экранирования в общем случае принимает вид: σ = σпара + σдиа + σ’
В результате, константа экранирования, а значит и резонансная частота, зависят от химического окружения атома водорода, поэтому сигналы протонов в различном положении разделены в спектре химическим сдвигом.
Другой характерной чертой спектров (рис.1) является т.н. мультиплетность пиков – сигналы некоторых протонов представлены не одиночными пиками (синглет), а системами из двух (дуплет), трех(триплет), четырех(квадруплет) и т.д. пиков. Причиной возникновения подобного эффекта является возникновение спин-спинового J-взаимодействия между соседними протонами. В результате образования химической связи между двумя атомами их электронные орбитали перекрываются и возникает общее электронное облако, которое обеспечивает возникновение магнитного взаимодействия между двумя ядрами и, как результат, образование мультиплетного сигнала.
МР-последовательности в спектроскопии: PRESS, STEAM
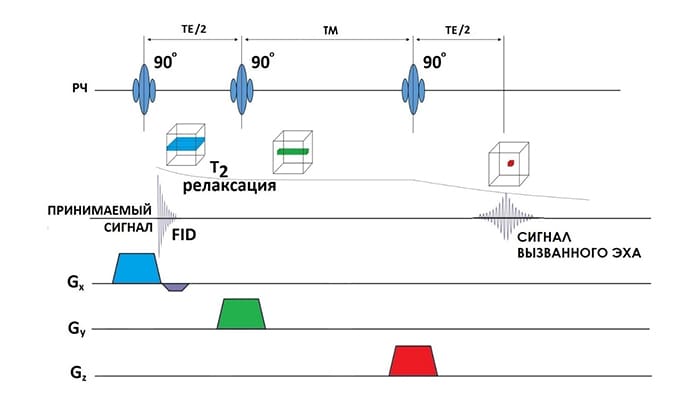
Для получения спектров наподобие (рис.1) используются различные импульсные последовательности (ИП), наиболее популярными из которых являются PRESS (Point Resolved Spectroscopy) [1] и STEAM (Stimulated Echo Acquisition Mode) [2]. Основной принцип, лежащий в основе подобных импульсных последовательностей, состоит в том, чтобы применить три взаимно ортогональных срез-селективных импульса и спроектировать последовательность импульсов так, чтобы собирать эхо-сигнал только из объема в пространстве, где пересекаются все три среза. Последовательность сконструирована таким образом, что сигналы из других областей за пределами желаемого вокселя исключались (обычно с помощью "уничтожающих (spoilers) градиентов") [3]
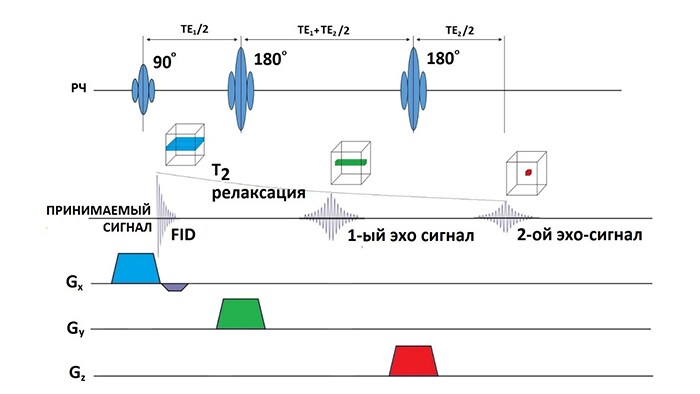
ИП PRESS основана на получении сигнала спинового эха тремя импульсами: возбуждающим (90°) и двумя инвертирующими (180°) (рис.3). Одновременно с широкополосными РЧ импульсами включаются срез-кодирующие градиенты, что приводит к выделению VOI на пересечении ортогональных возбужденных срезов (2-ой эхо сигнал). Кроме срез-селектирующих градиентов, применяются уничтожающие (spoilers) градиенты вокруг 180° РЧ импульсов для подавления нежелательных сигналов за пределами объема интереса. Через время, равное времени эхо (ТЕ), происходит регистрация сигнала из выбранного вокселя, причем минимальное время ТЕ определяется длительностями РЧ импульсов и соответствующих градиентов.
В случае ИП STEAM выделение VOI происходит с помощью возбуждения образца тремя 90º РЧ импульсами, (рис.4), как и в предыдущем случае с каждым РЧ импульсом одновременно включается 3 ортогональных срез кодирующих градиента). В результате получают сигнал вызванного эха (англ. stimulated echo) [4]. Сигнал вызванного эха формируется спинами, которые в промежутке времени между 2-ым и 3-им 90º РЧ импульсами (время смешивания (ТМ)) находятся не в плоскости xy, а в плоскости zx, где не подвергаются расфазировке, а релаксируют с постоянной Т1. Использование 90º РЧ импульсов и формирование сигнала вызванного эха в STEAM позволяет существенно снизить ТЕ (Рис.4), уменьшая тем самым потерю интенсивности сигналов из-за Т2 релаксации и спин-спинового взаимодействия. Отношение сигнал/шум (SNR) сигнала вызванного эха, получаемого в STEAM, в общем случае в 2 раза ниже, чем для сигнала эха(PRESS), так как не все спины сфазируются одновременно [4], поэтому в 1Н МРС головного мозга чаще используется именно ИП PRESS и модификации на ее основе.
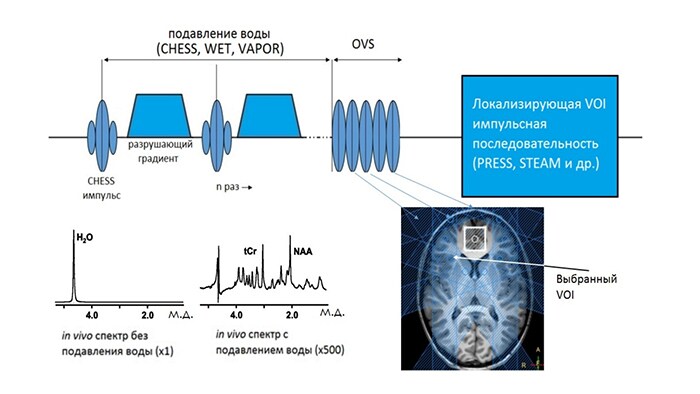
Методики подавления сигнала воды.
Однако получение спектра, как (рис.1), с помощью описанных последовательностей было бы невозможно без их дополнения важнейшей методикой – подавлением сигнала воды. Например, в паренхиме головного мозга концентрация воды на 3-5 порядков превосходит концентрации исследуемых метаболитов. Как следствие, в 1Н МР спектре становится невозможным наблюдать сигналы метаболитов на фоне интенсивного сигнала воды. Для решения данной проблемы используется предварительное подавление нежелательного сигнала воды δH2O = 4.76 м.д.. Наиболее часто применяемый метод подавления состоит в преднасыщении этого сигнала с помощью возбуждающих (90°) частотно-селектирующих импульсов (Chemical-shift-selective saturation (CHESS)) [5] с последующим расфазированием сигнала воды в поперечной плоскости с помощью расфазирующих градиентов (англ. spoiled gradients). Одного такого цикла обычно недостаточно для удовлетворительного подавления, поэтому используют 3-4 (water suppression enhanced through T1 effects – (WET) [6]) или 7 циклов (variable power and optimized relaxation delays – (VAPOR) [7]) с CHESS импульсами различной длительности и θ(t) для учета вариаций Т1 и неоднородностей поля B1 [8]. Иногда требуется дополнительное подавление сигналов жиров и воды, для чего часто используют насыщающие импульсы, которые располагают вне VOI (outer-volume suppression pulses (OVS)). Общая схема подавления сигналов воды и жира представлена на рис.5.
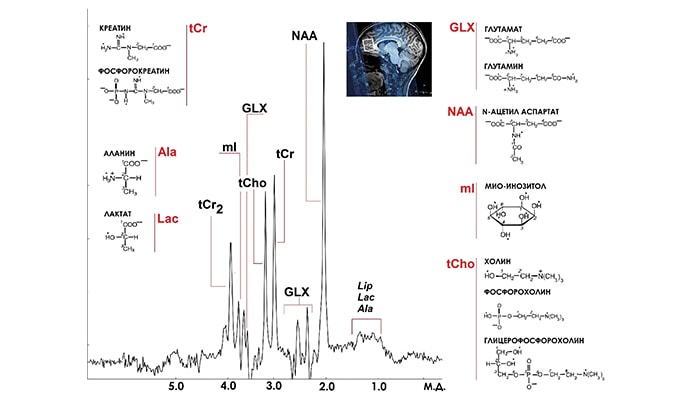
Типичный PRESS спектр головного мозга. Разрешенные сигналы, важнейшие церебральные метаболиты.
Таким образом, используя рассмотренные методики можно получить типичный PRESS спектр головного мозга (рис.1), который служил для нас хорошим примером типичного МР-спектра при рассмотрении физических основ МРС в первых разделах статьи. Теперь пришло время разобраться в том, что же означают и чему соответствуют пики в этом спектре. Мы надеемся, что для Вас теперь должно быть очевидно, что каждый из пиков в спектре соответствует сигналу протона в составе того или иного химического соединения, который находится в достаточном количестве в области интереса – спектроскопическом вокселе (VOI). Если этот сигнал не перекрывается с другими и при этом имеет достаточно высокую амплитуду (по сравнению с амплитудой шума), то говорят, что этот сигнал разрешен в этом спектре и его можно количественно оценить. Основной количественной оценкой в спектроскопии является площадь под пиком, которая оказывается пропорциональной концентрации тех молекул, которым принадлежит резонирующий протон. Именно этот факт позволяет с помощью спектров оценивать относительные концентрации веществ и их корреляции друг с другом. Учитывая, что в обычном PRESS спектре (3Т) мозга человека (рис.1) разрешены сигналы ряда важнейших метаболитов [1], можно говорить о том, что МРС открывает окно в неинвазивном изучении биохимии мозга в норме и при патологии. Вещества, сигналы которых разрешены в PRESS спектре (3Т) мозга человека, играют решающую роль в нормальном функционировании центральной нервной системы (ЦНС), поэтому ниже мы кратко приводим роль каждого из них в отдельности.
1) сигнал N–ацетильной группы N-ацетиласпартата (NАА, δNAA = 2.01 м.д.) c малым вкладом (не более 20%) сигнала N–ацетильной группы N-ацетиласпартил глутамата (NAAG, δNAAG = 2.04 м.д.). Исследования экстрактов культур нейронов и астроцитов [9], данные иммуногистохимических анализов [10] показали, что NAA локализуется в нейронах. Поэтому интенсивный сигнал N-ацетильной группы NAA в протонных МР спектрах головного мозга используется как неинвазивный нейрональный маркер. Обратимое снижение интенсивности этого сигнала интерпретируется как индикатор снижения и восстановления уровня нормально функционирующих нейронов [11,12]. В норме концентрация NAA в зависимости от локуса варьируется в пределах 8 – 17 мМ [13]. При этом, в среднем, в сером веществе концентрация NAA выше, чем в белом –15 мМ против 9 мМ [14]. Синтезируется NAA в митохондриях нейронов из аспартата (Asp) и ацетил-коэнзима А (AcCoA) под действием L–аспартат–N–ацетилтрансферазы [15–17], в незначительных количествах NAA образуется как продукт катаболизма нейротрансмиттера NAAG [18,19].
2) сигнал протонов группы N+(CH3)3 холинсодержащих соединений (tCho, δtCho = 3.18 м.д.). Сигнал tCho представляет собой суперпозицию сигналов фосфохолина (PC), глицерофосфохолина (GPC) и холина (Cho) – соединений, которые являются участниками липидного обмена. Основной вклад в сигнал tCho в мозге вносит GPC. Изменение интенсивности tCho служит индикатором нарушений этого обменного процесса [20]. В зависимости от локализации концентрация tCho, измеренная с помощью 1Н МРС, варьируется от 2.5 до 5 мМ [13].
3) сигнал N-метильных (tCr, δtCr=3.02 м.д.) и метиленовых (tCr2, δtCr2=3.89 м.д.) протонов креатина (Cr) и фосфоркреатина (PCr). PCr образуется путем переноса фосфатной группы от аденозинтрифосфата (ATP) на Cr под действием креатинкиназы. Реакция обратима, и при необходимости восполнения ATP, например, в условиях ишемии, равновесие сдвигается в сторону образования ATP: PCr фосфорилирует аденозин дифосфат (ADP) с образованием ATP и Cr. При этом в 1Н МР спектрах интенсивность сигналов Cr+PCr (tCr) остается постоянной [1]. Она также мало изменяется с возрастом [21]. Поэтому зачастую сигнал tCr с δtCr=3.02 м.д. используют при анализе спектров мозга как концентрационный стандарт и нормируют на него интенсивности остальных сигналов [22]. Концентрация tСr (7-16 мМ) зависит от выбора локуса мозга [13,23], причем содержание tСr в GM выше, чем в WM [23].
4) сигналы –СН- (δGLX = 3.74 м.д.) и обеих –CH2–групп (δGLX = 2.12-2.46 м.д.) относятся к глутамату и глутамину (GLX). Глутамат (Glu) – основной возбуждающий нейромедиатор в центральной нервной системе (ЦНС) человека. Glu является единственным субстратом в реакции синтеза основного тормозного нейромедиатора – γ-аминомасляной кислоты (GABA). Вследствие схожести химических структур все резонансы Glu и Gln накладываются друг на друга, что делает невозможным определение концентраций этих соединений по данным традиционных in vivo 1Н МРС спектров в полях 1.5-7 Тл [24].
5) сигнал 1,3,4,6 – протонов шестичленного кольца инозитола (mI, δmI = 3.56 м.д.) [25]. Глиальный маркер mI является осмолитом в астроцитах. Кроме того, mI - участник липидного метаболизма и метаболизма вторичных полифосфатных мессенджеров [9].
В условиях гипоксии и ишемии в спектрах появляется дублет метильной группы лактата (Lac, δLac = 1.34 м.д.). Сигнал метильных и метиленовых протонов (Lip, δLip = 0.9 и 1.3 м.д.) относят к жирнокислотным фрагментам липидов. Его появление в спектрах головного мозга вызвано, обычно, деградацией клеточных мембран [26].
Перспективы клинического применения 1Н-МРС
Область 1Н-МРС исследований активно развивается. Свое применение она находит в исследовании биохимических нарушений в мозге человека в результате различных патологий, таких как легкая и тяжелая черепно-мозговая травма, ишемия, нейродегенеративные заболевания и тд. Также значимыми для фундаментальной науки являются МРС исследования мозга в норме: в покое и при различной активации – зрительной, слуховой, болевой и т.п. Однако исследование области головного мозга не исчерпывает всего спектра возможный применений МРС. Эта методика также успешно применяется при изучении мышечной ткани, жировой ткани в различных локализация, таких как внутренние органы и костный мозг, а также при исследовании опухолей различного типа.
1Н-МРС головного мозга человека при нейродегенеративных заболеваниях
1Н-МРС является незаменимой в изучении влияния нейродегенеративных болезней на биохимические изменения в церебральных тканях. Так в исследовании [27] изучаются изменения, к которым приводит болезнь Паркинсона (БП). В 1H МРС 3Т исследовании приняли участие 12 здоровых добровольцев и 12 пациентов с БП. Относительные значения интегральных интенсивностей Glu/Сr, NAA/Cr и Cho/Cr, определяли из протонных MR-спектров задней поясной извилины, полученных с помощью ИП PRESS при TE=80 мс на аппарате 3T Philips Intera. Результаты показывают, что соотношение Glu/Cr было снижено у пациентов с БП по сравнению с контрольной группой (t=2,54; P=0,019), тогда как никаких различий не наблюдалось для NAA/Cr или Cho/Cr. Благодаря этим результатом было впервые показано, что Glu уменьшается при БП. Такое исследование является шагом в понимании физиологических процессов, лежащих в основе этой патологии.
В другой работе [28] с помощью 1Н-МРС изучались возможные биомаркеры болезни Альцгеймера (БА). В этом исследовании 17 здоровых людей из контрольной группы и 19 субъектов с БА были исследованы с помощью ИП PRESS c TE=135 мс, 3Т. В результате, по сравнению с контрольной группой у пациентов с БА были снижены уровни NAA/Cr в гиппокампе (с 42,3% до 26,0%, p <0,001), задней поясной извилине (от 10,4% до 0,2%, p = 0,04) и теменной доле (14,9%). до 3,8%, p = 0,002). Также наблюдались различия Cho/Cr и mI/Cr в гиппокампе (Ch /Cr: p = 0,04; m /Cr: p = 0,015) и задней поясной извилине (Cho/Cr: p = 0,001; mI/Cr: p = 0,001). Значения NAA/Cr в гиппокампе показали самую высокую чувствительность (94,1%) и специфичность (92,3%) для дифференциации БА и контрольной группы. Таким образом, 1H-MRS показала себя подходящим методом в изучении БА. Предположительно, изменения концентрации метаболитов в разных регионах отражают разные патологические изменения, сопровождающие БА.
1Н-МРС в кардиологии
МРС можно использовать для неинвазивного изучения изменений сердечного метаболизма in vivo. 1H-MRS в кардиологии используется в основном для определения миокардиального триглицерида (ТГ) и общего Cr. Накопление ТГ в миокарде у людей связано со старением [29], диабетом [30,31] и ожирением [32]. Было показано, что 1H-MRS достаточно чувствительна, чтобы обнаруживать изменения в содержании ТГ в миокарде в результате голодания и ограничения калорийности [33]. Кроме того, в сердечном энергетическом метаболизме важна креатин киназа, поскольку она участвует в синтезе АТФ. Достаточные уровни сердечного Cr необходимы для поддержания работоспособности системы креатин киназы. Общие уровни Cr в миокарде, то есть свободный Cr и PCr, можно определить с помощью 1H-MRS. Было показано, что у людей общий уровень Cr в миокарде снижается при дилатационной кардиомиопатии [34], гипертрофической кардиомиопатии [35], ишемической болезни сердца [35] и хронической сердечной недостаточности [36]. Таким образом, методы МРC позволяют отслеживать прогрессирование заболевания и реакцию на лечение или изменение образа жизни.
1Н МРС в онкологии
Онкология является областью, в которой любая дополнительная информация может оказаться незаменимой для принятия решения об оперативном вмешательстве или проведении соответствующей терапии. 1H-МРС в нейроонкологии позволяет получить дополнительную информацию, относящуюся к пролиферации и метаболизму опухолей или повреждению нейронов [37]. МРС хорошо себя зарекомендовала в решении таких задач, как определение типов новообразований и их агрессивности, дифференциация опухолей от других поражений, прогнозирование ответа опухоли на лечение и прогнозирование терапии, определением целевого объема для лучевой терапии, а также обнаружение рецидива опухоли [38–41]. Например, увеличение сигнала Cho в опухолях головного мозга указывает на повышенную скорость перестройки мембран [41]. Повышенный Cho наряду с уменьшением NAA является диагностическим признаком опухолей головного мозга.
Кроме этого, 1H-МРС может помочь дифференцировать доброкачественные и злокачественные поражения мягких тканей. Как показано в [42] отсутствие пика Cho в опухолях высокой степени злокачественности может говорить о значительных поражениях мягких тканей. В [43] было обнаружено, что сигнал Cho имел 88% чувствительность и 68% специфичность при обнаружении злокачественных поражений опорно-двигательного аппарата. Аналогичным образом [44] сообщили, что холин имел чувствительность 72,2% и специфичность 83% при обнаружении злокачественных опухолей костей и мягких тканей.
Связанные решения
-
Spectroscopy
Полный набор методов протонной спектроскопии с использованием одного воксела, нескольких вокселов и нескольких срезов, полностью интегрированный в пользовательский интерфейс сбора данных. Сочетание спектроскопической визуализации в турбо-режиме, технологии dS SENSE и анизотропной матрицы может помочь сократить время сканирования. Включает в себя пакет SpectroView Analysis для визуализации и обработки всех спектроскопических данных.
NMRB487
Список использованной литературы: [1] P.B. Barker, A. Bizzi, N. De Stefano, R. Gullapalli, D.D.M. Lin, Clinical MR Spectroscopy: Techniques and Applications, Cambridge University Press, Cambridge, UK, 2009. www.doi.org/10.1017/CBO9780511770647. [3] P.H. Lai, S.S. Hsu, S.W. Ding, C.W. Ko, J.H. Fu, M.J. Weng, L.R. Yeh, M.T. Wu, H.L. Liang, C.K. Chen, H. Ben Pan, Proton magnetic resonance spectroscopy and diffusion-weighted imaging in intracranial cystic mass lesions, Surg. Neurol. 68 (2007). www.doi.org/10.1016/j.surneu.2007.07.080. [4] D. Burstein, Stimulated echoes: Description, applications, practical hints, Concepts Magn. Reson. 8 (1996) 269–278. www.doi.org/10.1002/(SICI)1099-0534(1996)8:4<269::AID-CMR3>3.0.CO;2-X. [5] A. Haase, J. Frahm, W. Hanicke, D. Matthae, 1H NMR Chemical Shift Selective Imaging, Phys. Med. Biol. 30 (1985) 341–344. www.doi.org www.doi.org/10.1088/0031-9155/30/4/008. [6] R.J. Ogg, P.B. Kingsley, J.S. Taylor, WET, a T1- and B1-Insensitive Water-Suppression Method for in Vivo Localized1H NMR Spectroscopy, J. Magn. Reson. Ser. B. 104 (1994) 1 - 10. www.doi.org/10.1006/jmrb.1994.1048. [7] I. Tkáč, Z. Starčuk, I.Y. Choi, R. Gruetter, In vivo 1H NMR spectroscopy of rat brain at 1 ms echo time, Magn. Reson. Med. 41 (1999) 649–656. www.doi.org/10.1002/(SICI)1522-2594(199904)41:4<649::AID-MRM2>3.0.CO;2-G. [8] P. Diehl, E. Fluck, H. Gunther, R. Kosfeld, Magnetic resonance spectroscopy and its applications in psychiatry., in: M. Rudin (Ed.), NMR Basic Princ. Prog., New York: Springer-Verlag, Heidelberg, Berlin, 1992: pp. 56–57. www.doi.org/10.1046/j.1440-1614.2002.00992.x. [9] S.S. Gill, R.K. Small, D.G.T. Thomas, P. Patel, R. Porteous, N. Van Bruggen, D.G. Gadian, R.A. Kauppinen, S.R. Williams, Brain metabolites as 1H NMR markers of neuronal and glial disorders, NMR Biomed. 2 (1989) 196–200. www.doi.org/10.1002/nbm.1940020505. [10] J.R. Moffett, M.A.A. Namboodiri, J.H. Neale, Enhanced carbodiimide fixation for immunohistochemistry: Application to the comparative distributions of N-acetylaspartylglutamate and N- acetylaspartate immunoreactivities in rat brain, J. Histochem. Cytochem. 41 (1993) 559–570. www.doi.org/10.1177/41.4.8450195. [11] F. Federico, I. Simone, V. Lucivero, P. Giannini, G. Laddomada, D. Mezzapesa, C. Tortorella, Prognostic Value of Proton Magnetic Resonance Spectroscopy in Ischemic Stroke, Arch Neurol. 55 (1998) 489–494. [12] M. Lemesle, P. Walker, F. Guy, P. D’Athis, T. Billiar, M. Giroud, C. Demougeot, A. Lalande, N. Baudouin, D. Martin, F. Brunotte, Multi-variate analysis predicts clinical outcome 30 days after middle cerebral artery infarction, Acta Neurol Scand. 102 (2000) 11–17. [13] L. Minati, D. Aquino, M. Bruzzone, A. Erbetta, Quantitation of normal metabolite concentrations in six brain regions by in vivo 1H-MR spectroscopy, J. Med. Phys. 35 (2010) 154–163. www.doi.org/10.4103/0971-6203.62128. [14] M. Inglese, H. Rusinek, I.C. George, J.S. Babb, R.I. Grossman, O. Gonen, Global average gray and white matter N-acetylaspartate concentration in the human brain, Neuroimage. 41 (2008) 270–276. www.doi.org/10.1016/j.neuroimage.2008.02.034. [15] C.N. Madhavarao, C. Chinopoulos, K. Chandrasekaran, M.A.A. Namboodiri, Characterization of the N -acetylaspartate biosynthetic enzyme from rat brain, J. OfNeurochemistry. 86 (2003) 824–835. www.doi.org/10.1046/j.1471-4159.2003.01905.x. [16] R. Margolis, S. Barkulis, A. Geiger, A COMPARISON BETWEEN THE INCORPORATION OF 14C FROM GLUCOSE INTO N-ACETYGL-ASPARTJC ACID AND ASPARTIC ACID IN BRAIN PERFUSION EXPERIMENT, J. Ncurochcmistry 1960. 413 (1960) 379–382. [17] M.E. Truckenmiller, M.A.A. Namboodiri, M.J. Brownstein, J.H. Neale, N-Acetylation of L- Aspartate in the Nervous System : Differential Distribution of a Specific Enzyme, J. Neurochernisrn. 45 (1985) 1658–1662. [18] M.B. Robinson, R.D. Blakelys, R. Couto, J.T. Coylenii, Hydrolysis of the Brain Dipeptide N-Acetyl-L-aspartyl-L-glutamate, J. Biol. Chem. 262 (1987) 14498–14506. [19] B. Slusher, M.B. Robinson, G. Tsai, M. Simmons, S. Richards, J.T. Coyle, Rat Brain IV-Acetylated Acidic Dipeptidase, J. Biol. Chem. 265 (1990) 21297–21301. [20] M. Kumar, S.P. Arlauckas, S. Saksena, G. Verma, R. Ittyerah, S. Pickup, A. Popov, E. Delykatny, H. Poptani, Magnetic resonance spectroscopy for detection of choline kinase inhibition in the treatment of brain tumors, Mol Cancer Ther. 14 (2015) 899–908. www.doi.org/10.1158/1535-7163.MCT-14-0775. [21] D.E. Saunders, F.A. Howe, A. Van Den Boogaart, J.R. Griffiths, M.M. Brown, Aging of the Adult Human Brain : In Vivo Quantitation of Metabolite Content With Proton Magnetic Resonance Spectroscopy, J Magn Reson Imaging. 9 (1999) 711–716. [22] J.F.A. Jansen, W.H. Backes, K. Nicolay, M.E. Kooi, 1H MR spectroscopy of the brain: Absolute quantification of metabolites, Radiology. 240 (2006) 318–332. www.doi.org/10.1148/RADIOL.2402050314. [23] Y. Wang, S.J. Li, Differentiation of metabolic concentrations between gray matter and white matter of human brain by in vivo 1H magnetic resonance spectroscopy, Magn. Reson. Med. 39 (1998) 28–33. www.doi.org/10.1002/mrm.1910390107. [24] S. Ramadan, A. Lin, P. Stanwell, Glutamate and glutamine: A review of in vivo MRS in the human brain, NMR Biomed. 26 (2013) 1630–1646. www.doi.org/10.1002/nbm.3045. [25] V. Govindaraju, K. Young, A.A. Maudsley, Proton NMR chemical shifts and coupling constants for brain metabolites, NMR Biomed. 13 (2000) 129–153. www.doi.org/10.1002/1099-1492(200005)13:3<129::AID-NBM619>3.0.CO;2-V. [26] C. Dali, L.G. Hanson, N.W. Barton, J. Fogh, Brain N -acetylaspartate levels correlate with motor function in metachromatic leukodystrophy, Neurology. 75 (2010) 1896–1903. [27] H.R. Griffith, O.C. Okonkwo, T. O’Brien, J.A. den Hollander, Reduced brain glutamate in patients with Parkinson’s disease, NMR Biomed. 21 (2008) 381–387. www.doi.org/10.1002/NBM.1203. [28] D.M. Bittner, H.J. Heinze, J. Kaufmann, Association of 1H-MR spectroscopy and cerebrospinal fluid biomarkers in Alzheimer’s disease: diverging behavior at three different brain regions, J. Alzheimers. Dis. 36 (2013) 155–163. www.doi.org/10.3233/JAD-120778. [29] R.W. Van Der Meer, J. Doornbos, S. Kozerke, M. Schär, J.J. Bax, S. Hammer, J.W.A. Smit, J.A. Romijn, M. Diamant, L.J. Rijzewijk, A. De Roos, H.J. Lamb, Metabolic imaging of myocardial triglyceride content: reproducibility of 1H MR spectroscopy with respiratory navigator gating in volunteers, Radiology. 245 (2007) 251–257. www.doi.org/10.1148/RADIOL.2451061904. [30] J.M. McGavock, I. Lingvay, I. Zib, T. Tillery, N. Salas, R. Unger, B.D. Levine, P. Raskin, R.G. Victor, L.S. Szczepaniak, Cardiac steatosis in diabetes mellitus: a 1H-magnetic resonance spectroscopy study, Circulation. 116 (2007) 1170–1175. www.doi.org/10.1161/CIRCULATIONAHA.106.645614. [31] L.J. Rijzewijk, R.W. van der Meer, J.W.A. Smit, M. Diamant, J.J. Bax, S. Hammer, J.A. Romijn, A. de Roos, H.J. Lamb, Myocardial steatosis is an independent predictor of diastolic dysfunction in type 2 diabetes mellitus, J. Am. Coll. Cardiol. 52 (2008) 1793–1799. www.doi.org/10.1016/J.JACC.2008.07.062. [32] M. Kankaanpää, H.R. Lehto, J.P. Pärkkä, M. Komu, A. Viljanen, E. Ferrannini, J. Knuuti, P. Nuutila, R. Parkkola, P. Iozzo, Myocardial triglyceride content and epicardial fat mass in human obesity: relationship to left ventricular function and serum free fatty acid levels, J. Clin. Endocrinol. Metab. 91 (2006) 4689–4695. www.doi.org/10.1210/JC.2006-0584. [33] J.S. Reingold, J.M. McGavock, S. Kaka, T. Tillery, R.G. Victor, L.S. Szczepaniak, Determination of triglyceride in the human myocardium by magnetic resonance spectroscopy: reproducibility and sensitivity of the method, Am. J. Physiol. Endocrinol. Metab. 289 (2005). www.doi.org/10.1152/AJPENDO.00095.2005. [34] I. Nakae, K. Mitsunami, T. Omura, T. Yabe, T. Tsutamoto, S. Matsuo, M. Takahashi, S. Morikawa, T. Inubushi, Y. Nakamura, M. Kinoshita, M. Horie, Proton magnetic resonance spectroscopy can detect creatine depletion associated with the progression of heart failure in cardiomyopathy, J. Am. Coll. Cardiol. 42 (2003) 1587–1593. www.doi.org/10.1016/J.JACC.2003.05.005. [35] I. Nakae, K. Mitsunami, S. Matsuo, T. Inubushi, S. Morikawa, T. Tsutamoto, T. Koh, M. Horie, Myocardial creatine concentration in various nonischemic heart diseases assessed by 1H magnetic resonance spectroscopy, Circ. J. 69 (2005) 711–716. www.doi.org/10.1253/CIRCJ.69.711. [36] I. Nakae, K. Mitsunami, S. Matsuo, T. Matsumoto, S. Morikawa, T. Inubushi, T. Koh, M. Horie, Assessment of myocardial creatine concentration in dysfunctional human heart by proton magnetic resonance spectroscopy, Magn. Reson. Med. Sci. 3 (2004) 19–25. www.doi.org/10.2463/MRMS.3.19. [37] K. Glunde, Z.M. Bhujwalla, Metabolic tumor imaging using magnetic resonance spectroscopy, Semin. Oncol. 38 (2011) 26–41. www.doi.org/10.1053/J.SEMINONCOL.2010.11.001. [38] T.R. McKnight, Proton magnetic resonance spectroscopic evaluation of brain tumor metabolism, Semin. Oncol. 31 (2004) 605–617. www.doi.org/10.1053/J.SEMINONCOL.2004.07.003. [39] A. Horská, P.B. Barker, Imaging of brain tumors: MR spectroscopy and metabolic imaging, Neuroimaging Clin. N. Am. 20 (2010) 293–310. www.doi.org/10.1016/J.NIC.2010.04.003. [40] L. Kwock, J.K. Smith, M. Castillo, M.G. Ewend, F. Collichio, D.E. Morris, T.W. Bouldin, S. Cush, Clinical role of proton magnetic resonance spectroscopy in oncology: brain, breast, and prostate cancer, Lancet. Oncol. 7 (2006) 859–868. www.doi.org/10.1016/S1470-2045(06)70905-6. [41] K. Glunde, Z.M. Bhujwalla, S.M. Ronen, Choline metabolism in malignant transformation, Nat. Rev. Cancer. 11 (2011) 835–848. www.doi.org/10.1038/NRC3162. [42] F. Russo, S. Mazzetti, G. Grignani, G. De Rosa, M. Aglietta, G.C. Anselmetti, M. Stasi, D. Regge, In vivo characterisation of soft tissue tumours by 1.5-T proton MR spectroscopy, Eur. Radiol. 22 (2012) 1131–1139. www.doi.org/10.1007/S00330-011-2350-9. [43] T.K. Subhawong, X. Wang, D.J. Durand, M.A. Jacobs, J.A. Carrino, A.J. Machado, L.M. Fayad, Proton MR spectroscopy in metabolic assessment of musculoskeletal lesions, AJR. Am. J. Roentgenol. 198 (2012) 162–172. www.doi.org/10.2214/AJR.11.6505. [44] S. Doganay, T. Altinok, A. Alkan, B. Kahraman, H.M. Karakas, The role of MRS in the differentiation of benign and malignant soft tissue and bone tumors, Eur. J. Radiol. 79 (2011). www.doi.org/10.1016/J.EJRAD.2010.12.089.
[2] J. Frahm, K.-D. Merboldt, W. Hänicke, Localized proton spectroscopy using stimulated echoes, J. Magn. Reson. 72 (1987) 502–508. www.doi.org www.dx.doi.org/10.1016/0022-2364(87)90154-5.