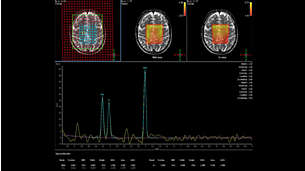
МРС – это уникальный метод, позволяющий измерять концентрации ряда важнейших метаболитов посредством получения и анализа МР-спектров. Методика MEGA-PRESS расширяет возможности обычного МРС исследования, позволяя определять концентрации основного тормозного нейромедиатора: нейромедиатора - ГАМК”.
Ахадов Толибджон Абдуллаевич
Заслуженный врач Российской Федерации, профессор, доктор медицинских наук, заведующий отделением лучевой диагностики НИИ Неотложной Детской Хирургии и Травматологии
Магнитно-резонансная спектроскопия (МРС) позволяет неинвазивно измерять локальные концентрации метаболитов мозга. На протяжении более чем 20 лет МР спектроскопия является методом изучения нейрометаболических процессов и их нарушений. Подробнее об основах протонной МР спектроскопии вы можете узнать в одной из наших предыдущих.
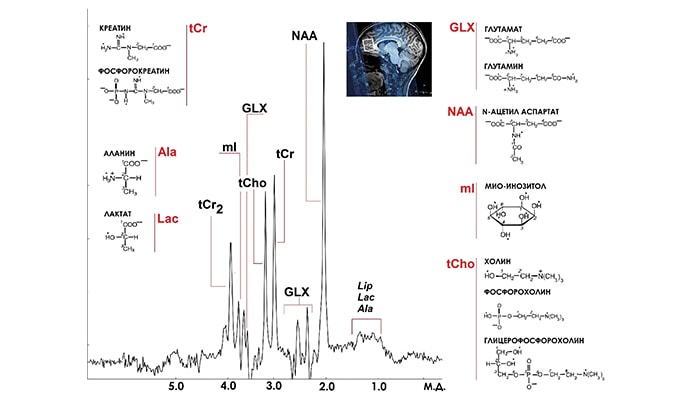
Даже одни из самых современных методик PRESS и STEAM позволяют достоверно регистрировать не более 7 сигналов (рис.1), в то время как в спектре головного мозга присутствует возможность измерения минимум еще 5 метаболитов, включая основной тормозной нейромедиатор - γ-аминомасляная кислота (ГАМК).
Роль γ-аминомасляной кислоты (ГАМК)
ГАМК является одним из наиболее интересных и перспективных для клинических исследований метаболитов.
ГАМК выступает в роли основного тормозного нейромедиатора в центральной нервной системе (ЦНС), осуществляя тем самым один из самых значимых для функционирования ЦНС процессов [1]. Помимо этой функции ГАМК участвует в процессах развития и формирования нейронных сетей, оказывает нейрорепаративное и нейропротекторное действие, участвует в регуляции тонуса сосудов. Значения концентрации ГАМК могут выступать в роли биомаркера состояния ГАМК-эргической системы при различных заболеваниях, а также в качестве показателя эффективности различных видов терапии.
Помимо нейромедиаторной функции, ГАМК осуществляет большое количество других, не менее важных, функций. Так, ГАМКэргическая система участвует в развитии ЦНС: в процессах миграции нервных клеток, роста аксонов и дендритов, образования синаптических связей. Направление миграции и роста нейронов может определяться нейротропными факторами, в роли которых и выступает ГАМК [1]. Активность связывания ГАМК с ГАМК-рецепторами оказывает защитное действие на олигодендроциты. Эти клетки вызывают образование миелина в ЦНС и, таким образом, являются основным компонентом белого вещества ЦНС [2].
Согласно исследованиям на животных, в периоды пластичности нейромедиаторная активность ГАМК может участвовать в правильном развитии и функционировании кортикальной нейронной сети [3]. Известна вовлеченность ГАМК в процессы кортикальной реорганизации при восстановлении моторных функций после инсульта. Так, по данным ПЭТ-исследования, выявлена повышенная активность связывания с ГАМКА рецепторами специфического, высокоафинного антагониста [18F] FMZ [4]. Наряду с этим, по данным МР спектроскопии, пациенты с низкими концентрациями несвязанной ГАМК показывают более высокие степени улучшения моторных характеристик.
Также существуют данные, свидетельствующие об участии ГАМК-ергической системы в регуляции мозгового кровообращения путем прямого воздействия на ГАМК рецепторы сосудистой стенки и за счет центральных механизмов, связанных с антиадренергическими эффектами [5]. Об этом свидетельствует тот факт, что циклические производные ГАМК, пирацетам и его аналоги фепирон и карфедон (фенотропил), в экспериментах и клинике улучшают мозговое кровообращение, восстанавливают нарушенные функции центральной нервной системы после ишемического инсульта [5].
Импульсная последовательность MEGA-PRESS
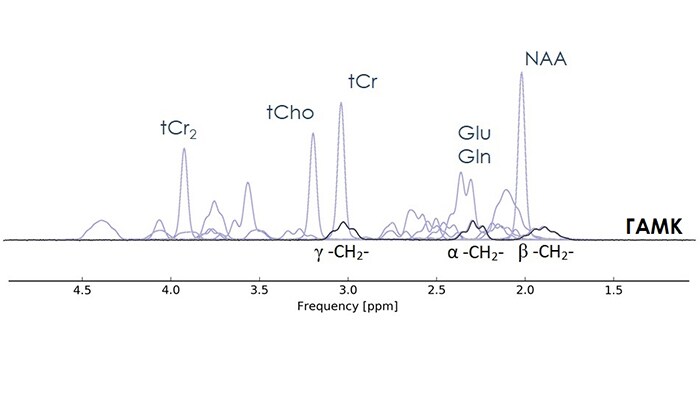
Основной проблемой получения информации о количественном содержании ГАМК в МР спектрах головного мозга является перекрывание всех трех сигналов ГАМК (α-СН2 δ =2.28 ppm; γ-СН2 δ = 3.01 ppm; β-CH2; δ =1.89 ppm) в спектрах головного мозга более интенсивными сигналами GLX, tCr и tNAA, соответственно (рис. 2) [6]. Для выделения сигнала ГАМК в спектрах, зарегистрированных на клинических МР сканерах, разработан ряд методик: COSY, J-PRESS, DQF. Однако наиболее подходящей для клинических исследований оказалась импульсная последовательность (ИП) MEGA-PRESS [7], которая и стала использоваться в качестве “золотого стандарта” для измерения концентрации ГАМК в мозге человека.
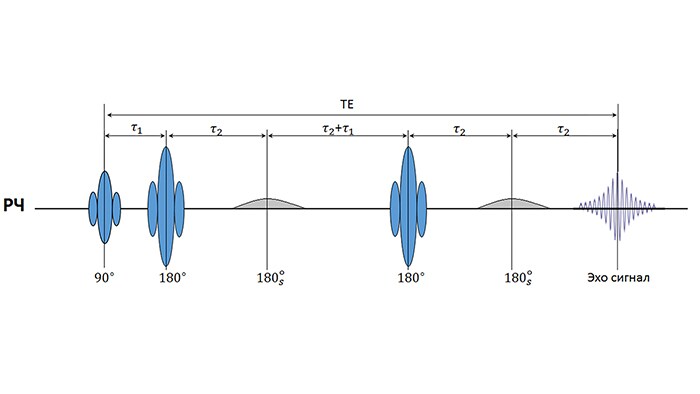
В основе работы ИП MEGA-PRESS (MEshcher-GArwood Point RESolved Spectroscopy) лежит явление спин-спинового взаимодействия (J-взаимодействие) [8]. J-взаимодействие - это взаимодействие между ядрами соседних групп в молекуле, передаваемое через электроны химической связи, которое приводит к расщеплению сигналов в мультиплеты, изменяя вид спектра и J-эволюцию ядерных спинов во времени. Селективное воздействие на протоны, связанные J-взаимодействием, позволяет через влияние на процесс J-эволюции перераспределять интенсивности компонент мультиплета и добиваться формы сигнала, удобной для последующего анализа. Подробнее с процессами J-эволюции и J-взаимодействия можно ознакомиться в [9], [10].
ИП MEGA-PRESS образована путем добавления в стандартную ИП PRESS двух селективных 180º рефокусирующих РЧ импульсов, как показано на рисунке 3. При этом осуществляется регистрация двух серий спектров: серия «ON» и серия «OFF» [8], которые отличаются наличием или отсутствием селективного воздействия на спиновую систему ГАМК, соответственно. При корректном выборе основных параметров ИП MEGA-PRESS (время эхо (ТЕ), частота и длительность селективных импульсов) вычитание OFF из ON серии приводит к отделению сигнала γ–СН2 – протонов (δ=3.01 ppm) ГАМК от интенсивного сигнала tCr (δ=3.01 ppm) [6] (рис 4А).
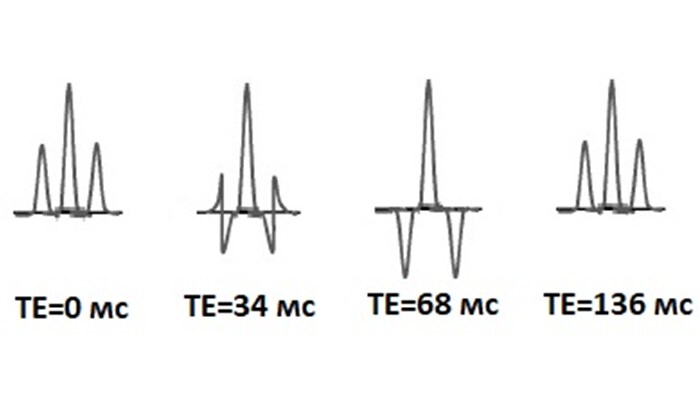
Рассмотрим подробнее механизм получения приведённого выше спектра MEGA-PRESS. В OFF серии селективные импульсы (δOFF=7.5 ppm) не воздействуют на спиновую систему ГАМК (рис 4Б) и, следовательно, J-эволюция не перефокусируется. На рисунке (рис 5) показана зависимость сигнала γ–СН2 – протонов (δ=3.01 ppm) ГАМК от различных ТЕ в OFF серии. При этом оптимальным временем для эха для регистрации MEGA-PRESS спектров является TE = 68 мс.
В ON серии селективные импульсы с δON=1.90 ppm воздействуют на протоны β-CH2 группы ГАМК c δ =1.89 ppm (протоны, связанные J-взаимодействием с γ-СН2 протонами), тем самым изменяя направление J-эволюции резонансов γ-СН2, δ =3.01 ppm. В результате сигнал ГАМК представляет собой сфазированный триплет (как при TE = 0, (рис. 5) независимо от выбранного ТЕ [8].
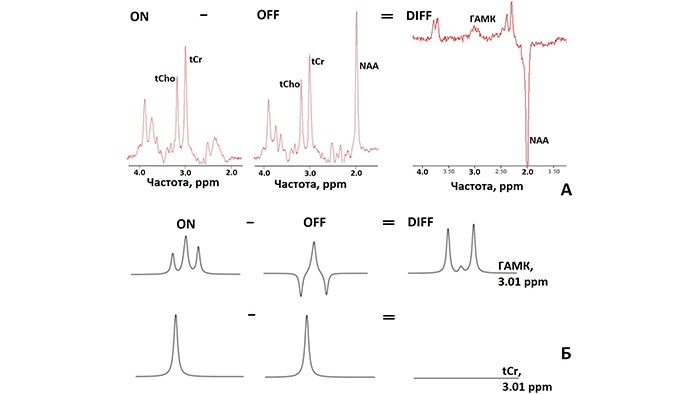
В обеих сериях сигнал tCr на δ=3.01 ppm остается неизменным, и при вычитании OFF-серии из ON-серии зануляется. Остается спектр (редактированный DIFF) (рис. 4Б) [6], содержащий неперекрытый сигнал ГАМК. Таким образом, результирующий спектр содержит неперекрытый сигнал ГАМК на δ = 3.01 ppm. Регистрация и последующий расчет концентраций ГАМК долгое время оставались исключительно научным функционалом МР томографа, однако сейчас измерения ГАМК доступны всем без исключения пользователям Philips.
Примеры научно-клинических исследований
Исследование ГАМК в норме и при различных патологиях является одним из наиболее популярных направлений в 1Н МР-спектроскопии. Измерение ГАМК в различных областях мозга (рис.6) позволяет получить незаменимую информацию о биохимических изменениях в ЦНС, которые могут свидетельствовать о функциональных и физиологических нарушениях.
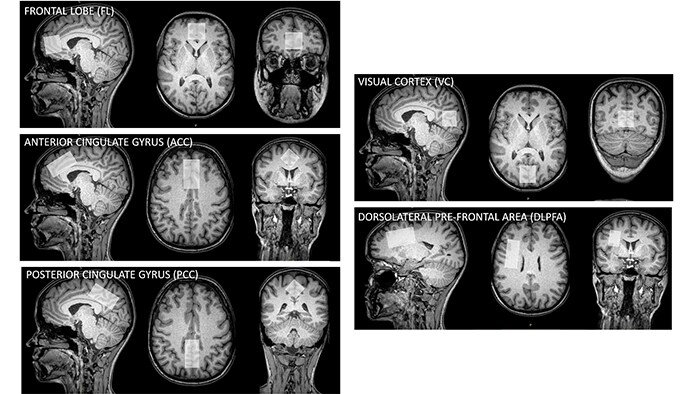
С каждым годом увеличивается интерес к измерению методом 1Н МРС содержания ГАМК в локусах мозга при различных патологиях. Наряду с определением уровней глутамата, основного возбуждающего нейромедиатора, исследования ГАМК являются одним из приоритетных направлений при изучении широкого ряда заболеваний, таких как психические заболевания (шизофрения, биполярные расстройства, депрессии, синдром дефицита внимания, аутизм и др. [11], [12]), демиелинизирующие заболевания (рассеянный склероз [13], болезнь Альцгеймера [14]), эпилепсия [15], алкогольные и наркотические зависимости [16] и др. Помимо
того, что нарушения работы ГАМКэргической системы могут быть причиной или следствием возникающих метаболических и функциональных изменений, существует множество свидетельств того, что препараты, применяемые при терапии, могут влиять на различные составляющие ГАМКэргической системы. Так, в [17] рост концентрации ГАМК по данным МРС у пациентов с эпилепсией связывают с принимаемыми препаратами (Габапентин, вигабатрин и другие). Считается также, что ряд других препаратов (бензодиазипин, фенобарбитал и др.) может оказывать механическое воздействие на ГАМК рецепторы, что, несомненно, также должно воздействовать и на концентрацию ГАМК [18].
Другим ярким примером может служить найденная исследователями НИИ Неотложной Детской Хирургии и Травматологии при поддержке Philips Clinical Science обратная зависимость между концентрацией ГАМК и суточной дозой принимаемых антипсихотиков у медикаментозно стабилизированных пациентов с ультравысоким риском развития шизофрении [19]. Эти данные открывают существенные возможности использования концентрации ГАМК, полученной методом МРС, в качестве неинвазивного биомаркера эффективности проводимой лекарственной терапии, что позволит своевременно корректировать такое лечение.
Связанные решения
-
Spectroscopy
Полный набор методов протонной спектроскопии с использованием одного воксела, нескольких вокселов и нескольких срезов, полностью интегрированный в пользовательский интерфейс сбора данных. Сочетание спектроскопической визуализации в турбо-режиме, технологии dS SENSE и анизотропной матрицы может помочь сократить время сканирования. Включает в себя пакет SpectroView Analysis для визуализации и обработки всех спектроскопических данных.
NMRB487
Связанные статьи
MEGA MR Clinical
Регистрационное удостоверение № ФСЗ 2011/10276 Томограф магнитно-резонансный Ingenia
Список литературы [1] M. Watanabe, K. Maemura, K. Kanbara, T. Tamayama, and H. Hayasaki, “GABA and GABA receptors in the central nervous system and other organs,” in International Review of Cytology, vol. 213, 2002, pp. 1–47. [2] C. Wu and D. Sun, “GABA receptors in brain development, function, and injury,” Metab. Brain Dis., vol. 30, no. 2, pp. 367–379, 2015. [3] D. D. Wang and A. R. Kriegstein, “Defining the role of GABA in cortical development,” in Journal of Physiology, 2009, vol. 587, no. 9, pp. 1873–1879. [4] N. J. Paik and E. J. Yang, “Role of GABA plasticity in stroke recovery,” Neural Regen. Res., vol. 9, no. 23, pp. 2026–2028, 2014. [5] В. Н. ПЕРФИЛОВА and Л. Е. БОРОДКИНА, “УЧАСТИЕ ГАММА-АМИНОМАСЛЯНОКИСЛОТНО-ЕРГИЧЕСКОЙ СИСТЕМЫ В РЕГУЛЯЦИИ МОЗГОВОГО КРОВООБРАЩЕНИЯ,” ВЕСТНИК РОССИЙСКОЙ ВОЕННО-МЕДИЦИНСКОЙ АКАДЕМИИ, 2014. [6] P. G. Mullins et al., “Current practice in the use of MEGA-PRESS spectroscopy for the detection of GABA,” NeuroImage, vol. 86. Academic Press Inc., pp. 43–52, 01-Feb-2014. [7] M. Mescher, A. Tannus, M. O’Neil Johnson, and M. Garwood, “Solvent suppression using selective echo dephasing,” J. Magn. Reson. - Ser. A, vol. 123, no. 2, pp. 226–229, 1996. [8] M. Mescher, H. Merkle, J. Kirsch, M. Garwood, and R. Gruetter, “Simultaneous in vivo spectral editing and water suppression,” NMR Biomed., vol. 11, pp. 266-272., 1998. [9] и др. Семенова Н.А., Меньщиков П.Е., Манжурцев А.В., “Динамика прижизненной концентрации метаболитов аминокислот в головном мозге человека в посттравматическом периоде,” Доклады Академии наук, vol. 484, no. 2, pp. 238–242, 2019. [10] F. Holger Försterling, Spin dynamics: Basics of Nuclear Magnetic Resonance, Second Edition, 2nd ed., vol. 37, no. 1. Wiley, 2009. [11] R. R. Schür et al., “Brain GABA levels across psychiatric disorders: A systematic literature review and meta-analysis of 1H-MRS studies,” Human Brain Mapping, vol. 37, no. 9. pp. 3337–3352, 2016. [12] P. E. Men’shchikov et al., “Spectral editing in proton magnetic resonance spectroscopy. Determination of GABA level in the brains of humans with ultra-high risk for schizophrenia,” Russ. Chem. Bull., vol. 64, no. 9, pp. 2238–2243, 2015. [13] N. Cawley et al., “Reduced gamma-aminobutyric acid concentration is associated with physical disability in progressive multiple sclerosis,” Brain, vol. 138, no. 9, pp. 2584–2595, 2015. [14] X. Bai et al., “Decreased γ-aminobutyric acid levels in the parietal region of patients with Alzheimer’s disease,” J. Magn. Reson. Imaging, vol. 41, no. 5, pp. 1326–1331, 2015. [15] F. A. Chowdhury et al., “Investigation of glutamine and GABA levels in patients with idiopathic generalized epilepsy using MEGAPRESS,” J. Magn. Reson. Imaging, vol. 41, no. 3, pp. 694–699, 2015. [16] K. C. Morley, J. Lagopoulos, W. Logge, K. Chitty, A. Baillie, and P. S. Haber, “Neurometabolite levels in alcohol use disorder patients during baclofen treatment and prediction of relapse to heavy drinking,” Front. Psychiatry, vol. 9, no. SEP, 2018. [17] J. U. Blicher et al., “GABA levels are decreased after stroke and GABA changes during rehabilitation correlate with motor improvement,” Neurorehabil. Neural Repair, vol. 29, no. 3, pp. 278–286, 2015. [18] J. I. Kang et al., “Reduced binding potential of GABA-A/benzodiazepine receptors in individuals at ultra-high risk for psychosis: An [18F]-fluoroflumazenil positron emission tomography study,” Schizophr. Bull., vol. 40, no. 3, pp. 548–557, 2014. [19] P. E. Menschikov et al., “1H-MRS and MEGA-PRESS pulse sequence in the study of balance of inhibitory and excitatory neurotransmitters in the human brain of ultra-high risk of schizophrenia patients,” Dokl. Biochem. Biophys., vol. 468, no. 1, pp. 168–172, 2016.