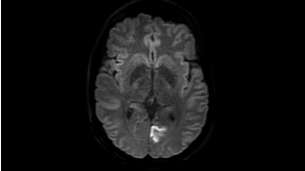
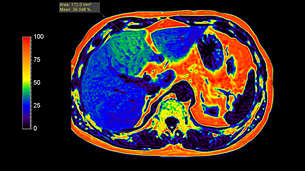
Агрессивные высокопролиферативные опухолевые ткани отличаются повышенными уровнями белков и пептидов. Их содержание коррелирует с грейдами, которые оцениваются по патологическим признакам, определенным Всемирной организацией здравоохранения (WHO grade). Методика Amide proton transfer позволяет визуализировать содержание эндогенных клеточных белков, что делает ее крайне перспективной для онкорадиологии"
Басалай Тимур Валерьевич
врач-рентгенолог, ГБУЗ «Морозовская ДГКБ ДЗМ»
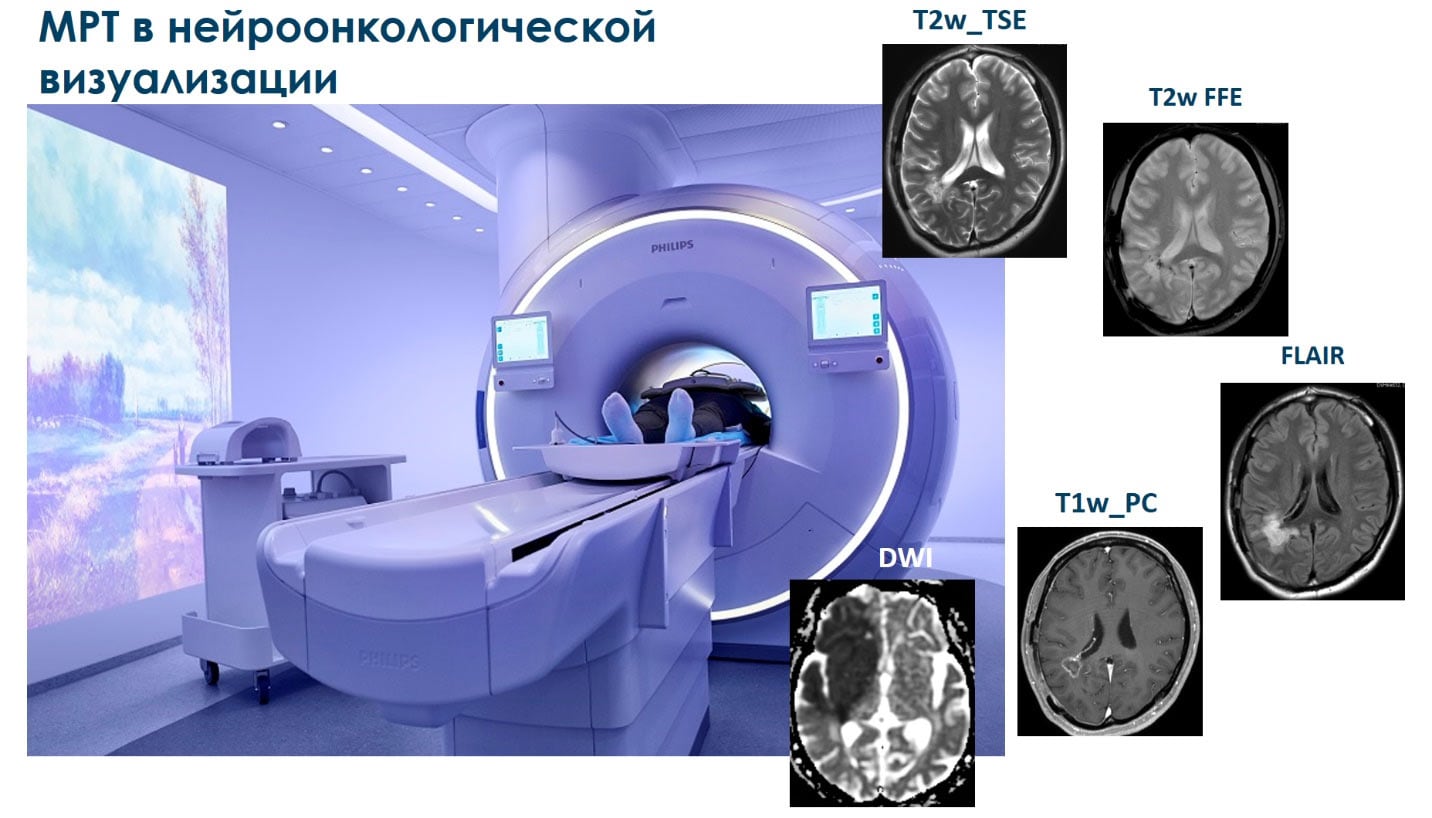
На сегодняшний день Магнитно-Резонансная Томография (МРТ) является одной из самых перспективных методик нейроонкологической визуализации. Набор стандартных последовательностей (T2 взвешенное быстрое спиновое эхо (T2w_TSE), T2 взвешенное быстрое градиентное эхо (T2w_FFE), инверсия-восстановление с подавлением воды (FLAIR), постконтрастные T1 взвешенные изображения (T1w_PC), диффузионно-взвешенные изображения (DWI), доступный на любом современном сканере, позволяет четко визуализировать опухоль, разделить солидную и некротизирующую области, области отека, оценить нарушение гематоэнцефалического барьера, динамически отследить развитие опухоли и многое другое1. Однако, до сих пор неинвазивная оценка степени злокачественности и агрессивности опухоли с помощью МРТ остается довольно сложной задачей.
Возможности МРТ выходят за рамки получения изображений, несущих только структурную и морфологическую информацию. Большой выбор количественных методов МРТ позволяет рассчитывать различные биофизические и биохимические параметры, которые могут выступать значимыми биомаркерами различных патологических состояний и быть полезными в их дифференциальной диагностике.
Методика Amide Proton Transfer (APT), уже находит свое применение в онкорадиологии пользователями Philips по всему миру.”
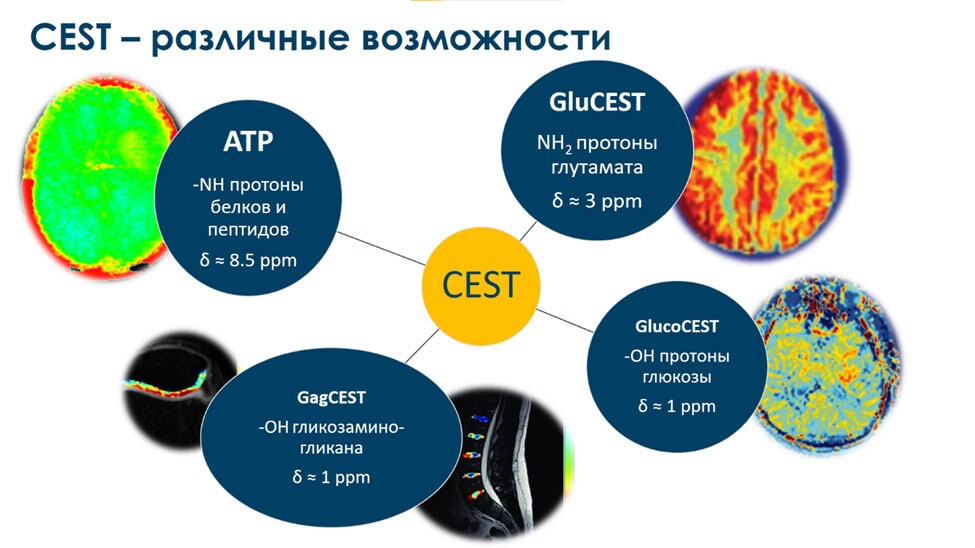
Без использования контрастных агентов методика APT позволяет значительно улучшить точность классификации опухолей и отслеживать изменения на всех этапах лечения [7]. Методика APT является частным случаям методики МРТ, основанной на физическом явлении переноса намагниченности, которая в англоязычной литературе носит название Chemical exchange saturation transfer (CEST)2. Все существующие возможности CEST методик 3–6 представлены на рис. 1.
Основы получения APT контраста
Любая биологически активная система крайне динамична, что подразумевает под собой огромное количество различных обменных процессов. Одним из таких процессов является непрекращающийся обмен протонами (H+), входящими в состав амидных групп (—NH) пептидов и белков с окружающими молекулами воды (H2O) (рис.3 А, Б). Именно этот процесс используется для получения APT контраста, в основе которого лежит визуализация количества белков в тканях.
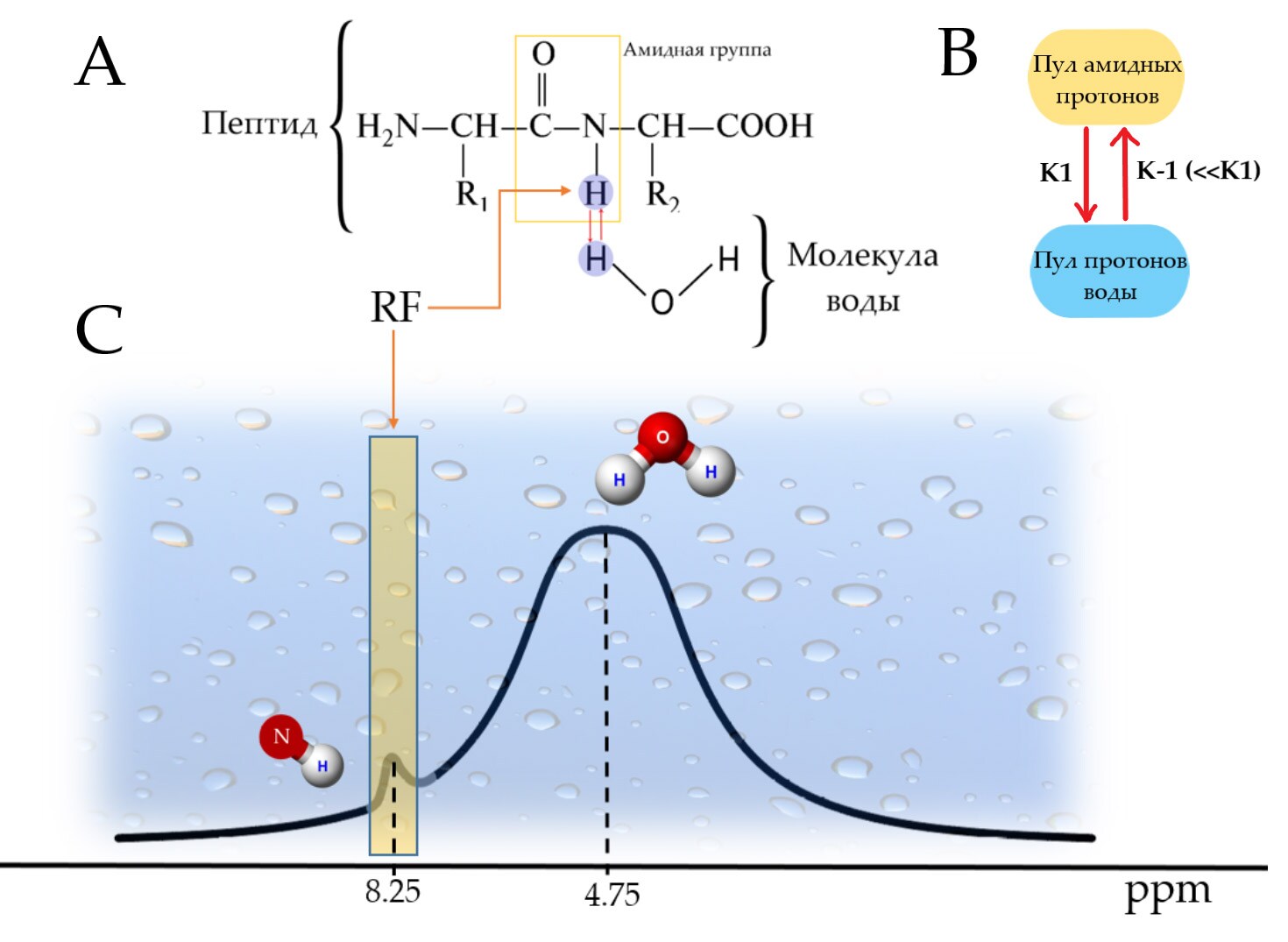
Протоны входящие в состав амидных групп (—NH) и воды резонируют на частотах, отличающихся друг от друга из-за явления химического сдвига (Химический сдвиг в ЯМР — смещение сигнала ЯМР в зависимости от химического состава вещества, обусловленное экранированием внешнего магнитного поля электронами атомов. Подробнее с концепцией химического сдвига можно ознакомиться здесь). Эти сдвиги частоты крайне малы и выражаются в милионных долях (ppm) от основной несущей частоты ЯМР сигнала - 4.75 ppm для протонов воды и 8.25 ppm для амидных протонов (рис.3.С).
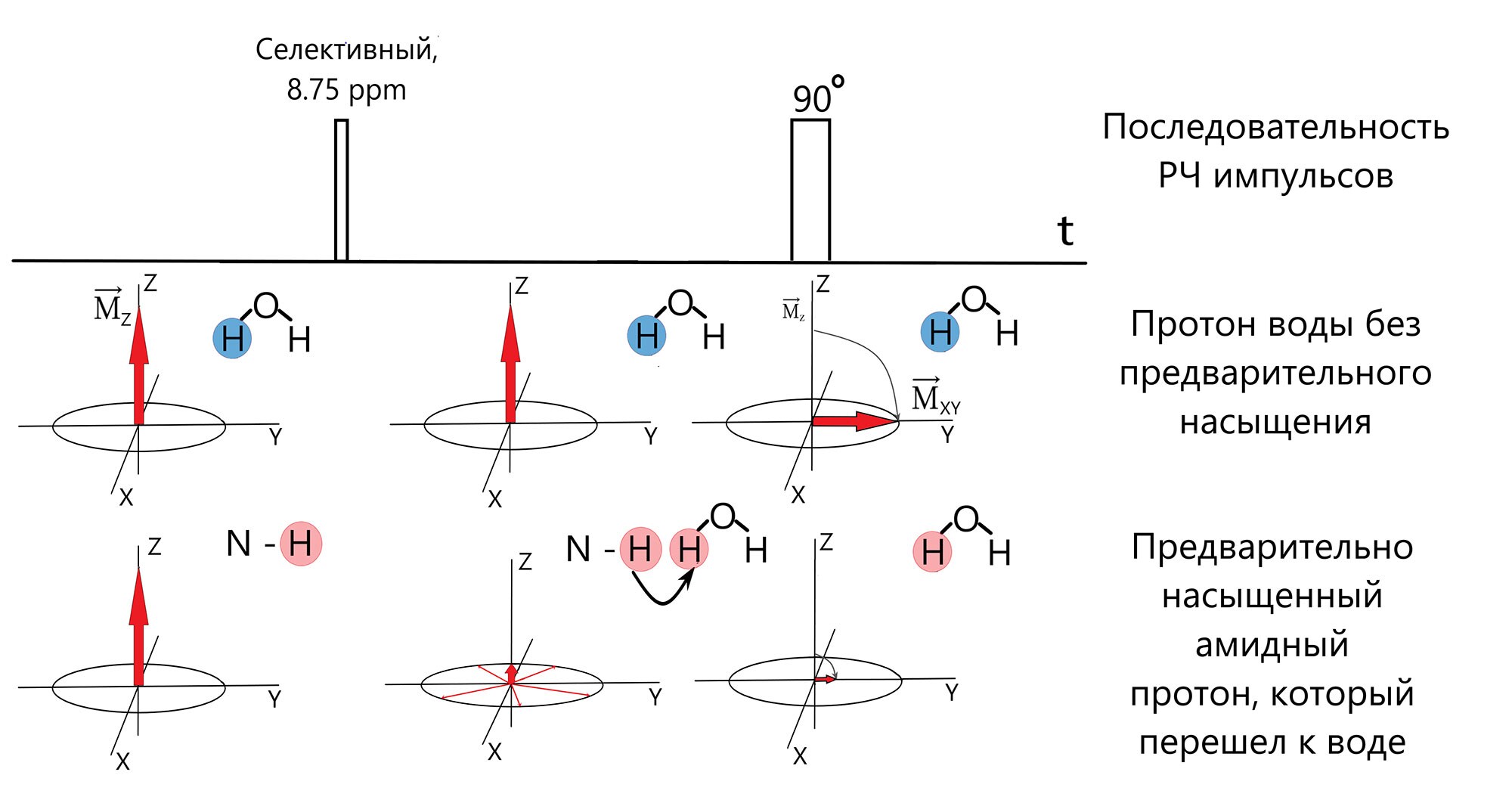
Как уже было сказано ранее, процесс перехода протонов из амидных групп белка к молекулам воды является ключевым для получения APT контраста. Для того, чтобы визуализировать данный переход, используется селективное насыщение (рис.3.С) сигнала протонов амидной группы преднасыщающим радиочастотным (РЧ) импульсом (Преднасыщающий импульс – РЧ импульс, подающийся до основного возбуждающего импульса). Термин “селективное насыщение” означает, что РЧ импульс воздействует только на узкую полосу частот, отвечающую резонансной частоте амидных протонов (8.25 ppm), таким образом возбуждение передаётся только амидным протонам.
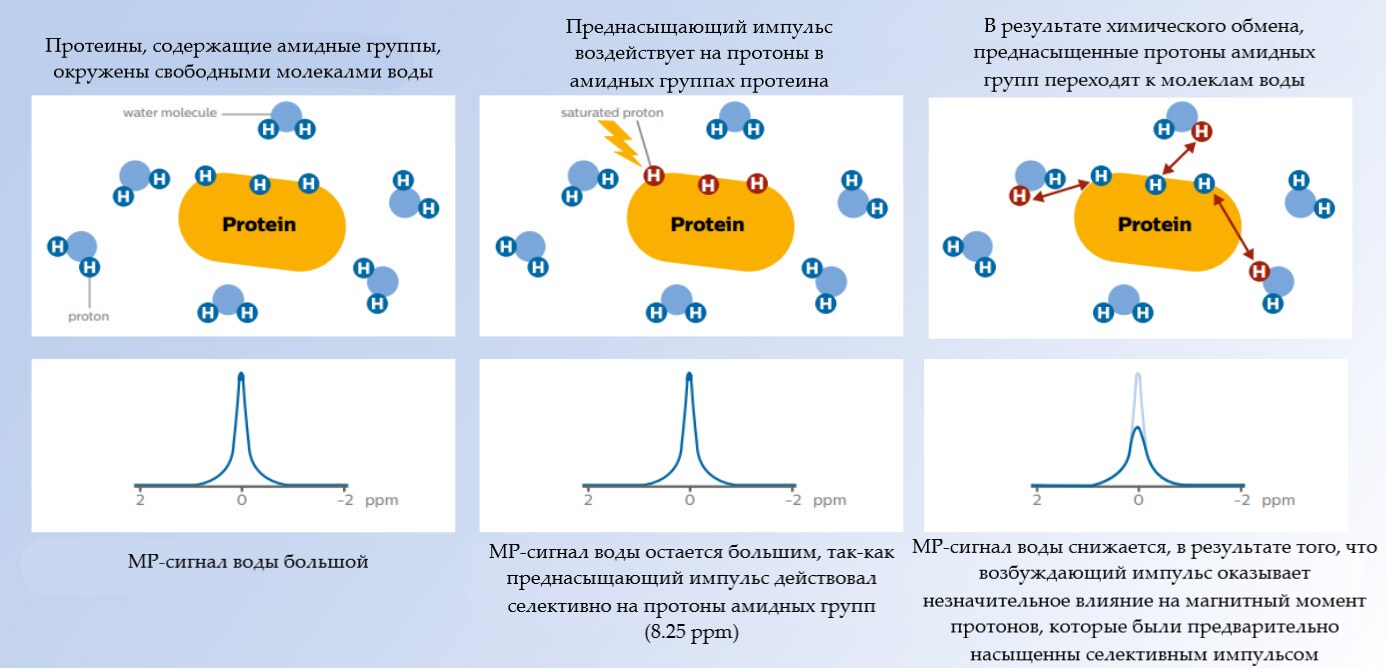
В результате обмена протонами амидных групп и воды, эти предварительно насыщенные протоны переходят к молекулам воды. При регистрации ЯМР сигнала оказывается, что в результате данного обмена, сигнал воды уменьшается (рис.4). Это снижение связано с тем, что возбуждающий импульс оказывает минимальное влияние на магнитные моменты протонов, которые были предварительно насыщенны, следовательно, их суммарный сигнал пренебрежительно мал. Это обусловлено тем, что намагниченность протонов, которые были заранее насыщенны и перешли к молекулам воды, уже находится в плоскости X-Y и ее Z-составляющая, на которую и действует 90° возбуждающий импульс, минимальна (рис.5).
Однако единоразового обмена протонами между амидными группами и молекулами воды было бы недостаточно, чтобы значительно уменьшить сигнал воды, так-как концентрация протонов амидных групп, как и самих протеинов, в миллионы раз меньше концентрации протонов воды. С другой стороны, это также означает, что вероятность возвращения преднасыщенного протона обратно в амидную группу стремится к нулю (k1≫ k(-1)), где k1 и k-1 это константы прямой и обратной реакции обмена между двумя пулами протонов, отражающие скорость протекания данных процессов (рис 3В). Таким образом, при достаточно малом времени обмена протонами и при достаточно большом времени воздействия селективного преднасыщающего импульса (tнас), в свободной воде накопится такое количество преднасыщенных протонов, которое будет достаточным для того, чтобы в значительной степени снизить сигнал воды. В итоге, сигнал воды, уменьшается пропорционально количеству протонов, перешедших от амидных групп к молекулам воды за время насыщения. В свою очередь, это означает, что это уменьшение сигнала воды также пропорционально концентрации белков и пептидов.
Процесс перехода протонов из амидных групп белка к молекулам воды является ключевым для получения APT контраста.”
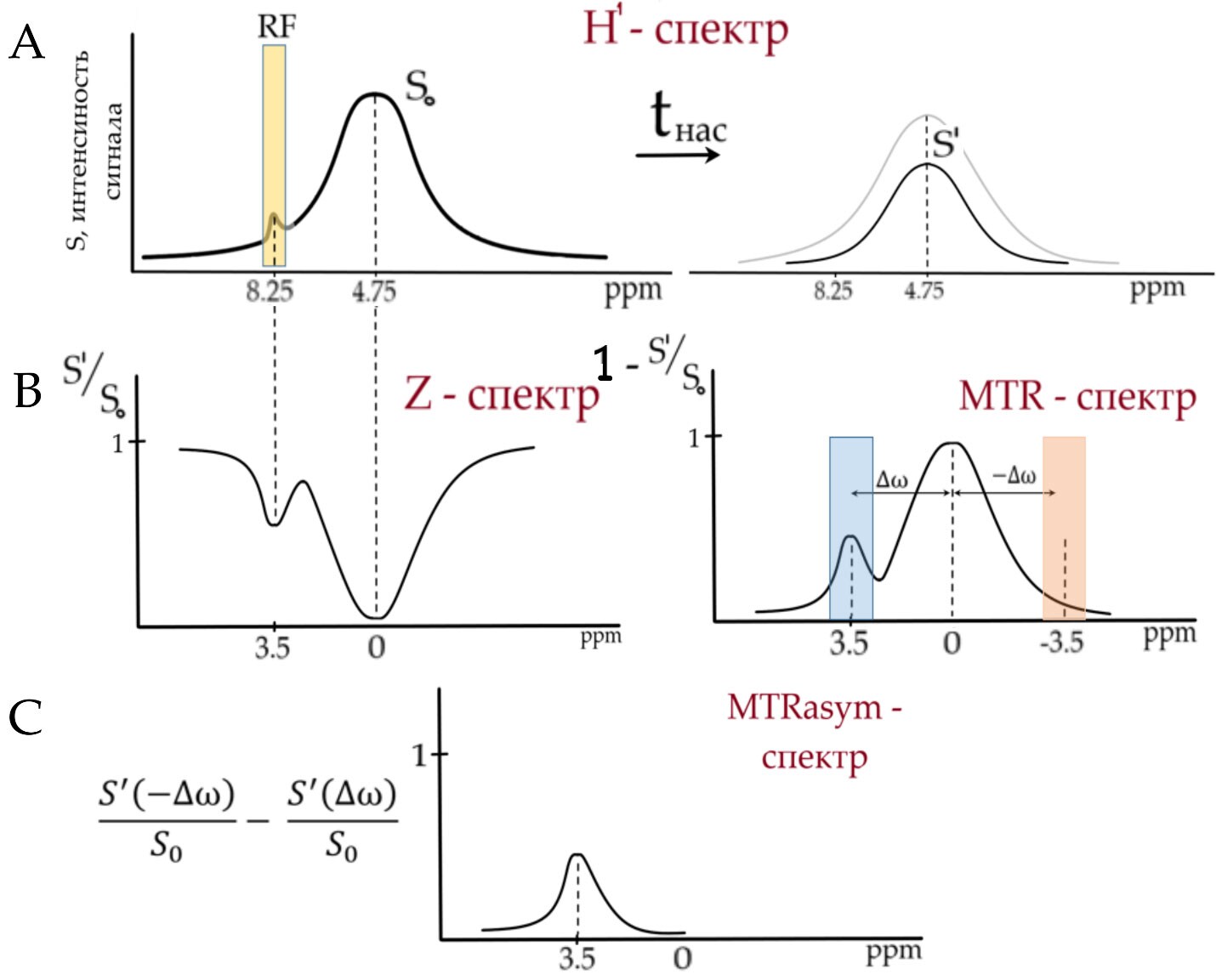
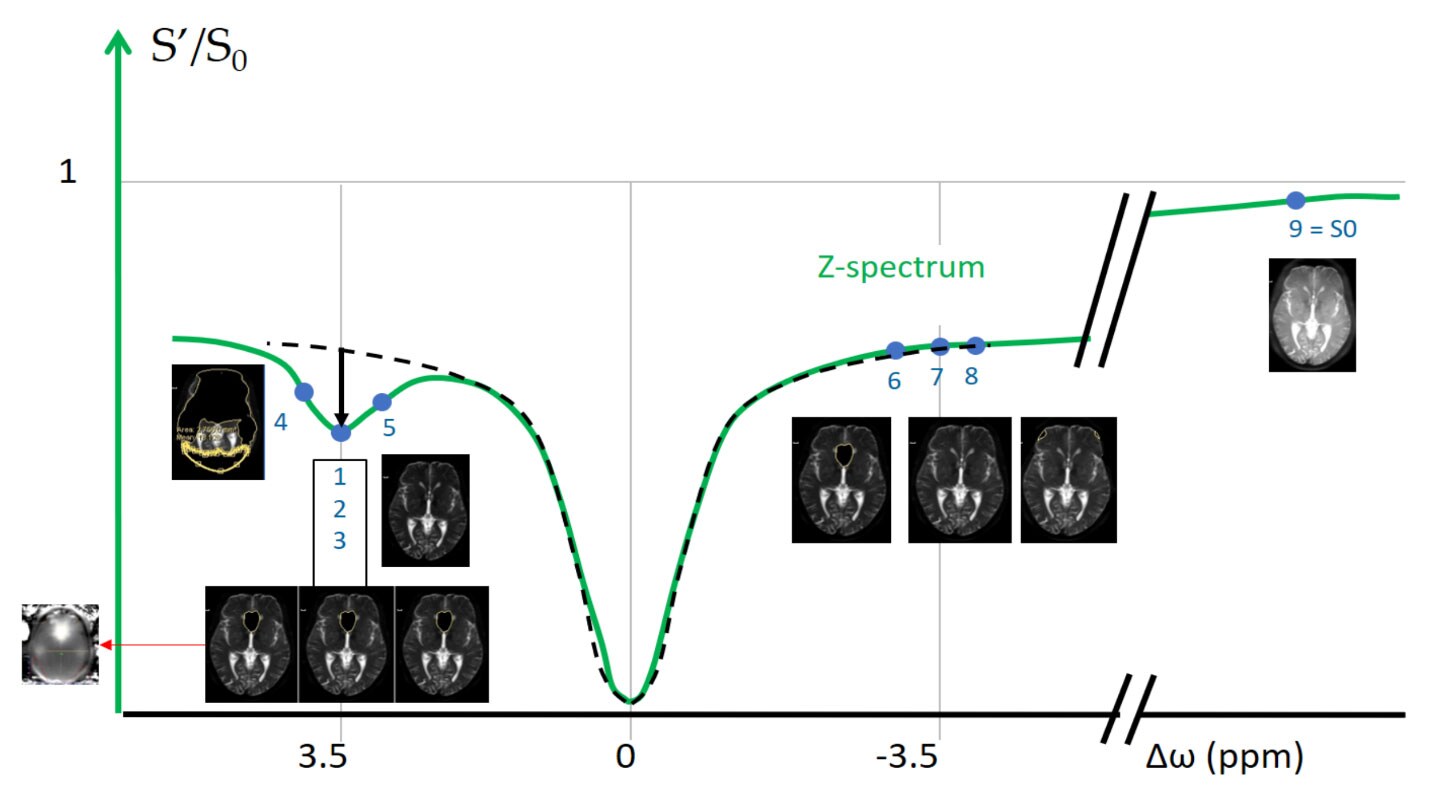
В реальном эксперименте для того, чтобы оценить относительные концентрации пептидов по изменению сигнала воды применяется концепции т.н. Z-спектра, MTR-спектра (magntitization transfer ratio) и MTRasym – спектра (magntitization transfer ratio asymmetry) (рис.5). Z-спектр представляет собой зависимость относительного сигнала воды S' / S0 (где S0 – интенсивность сигнала воды до преднасыщающего импульса, S' - после) от частоты (ppm) на которой воздействует селектирующий преднасыщающий импульс. В Z-спектре в качестве нулевой частоты устанавливается частота основного сигналы воды (4.75 ppm → 0 ppm), что, зачастую, вводит в заблуждение специалистов МР-спектроскопии. Таким образом, применяя преднасыщающий импульс в 0 ppm Z-спектра (4.75 ppm в H1-спектре) происходит насыщение всего пула свободной воды, в результате чего сигнал воды будет нулевым и тд. При воздействии преднасыщающего импульса на частоте 3.5 ppm в Z спектре (8.25 в H1-спектре) происходит насыщение амидных протонов и значение S' / S0 значительно уменьшается. При воздействии преднасыщающего импульса на периферии (ppm), значение S' / S0 приближенно равно единице, так как такой импульс не затрагивает ни амидные протоны, ни протоны воды. MTR-спектр можно считать перевернутым Z-спектром, так-как это, в свою очередь, зависимость 1- S' / S0 от частоты воздействия преднасыщающего импульса. Спектр MTRasym рассчитывается как разность значений MTR спектра при положительных и отрицательных значениях частоты (ppm).
В результате интенсивность MTRasym спектра можно считать пропорциональной количеству амидных протонов, которые повлияли на уменьшение сигнала воды, и, соответственно, концентрации пептидов, которым они принадлежали. Рассчитывая такие спектры в каждом из вокселей возможно получение APT карт, отображающих распределения белков и пептидов в мозге человека.
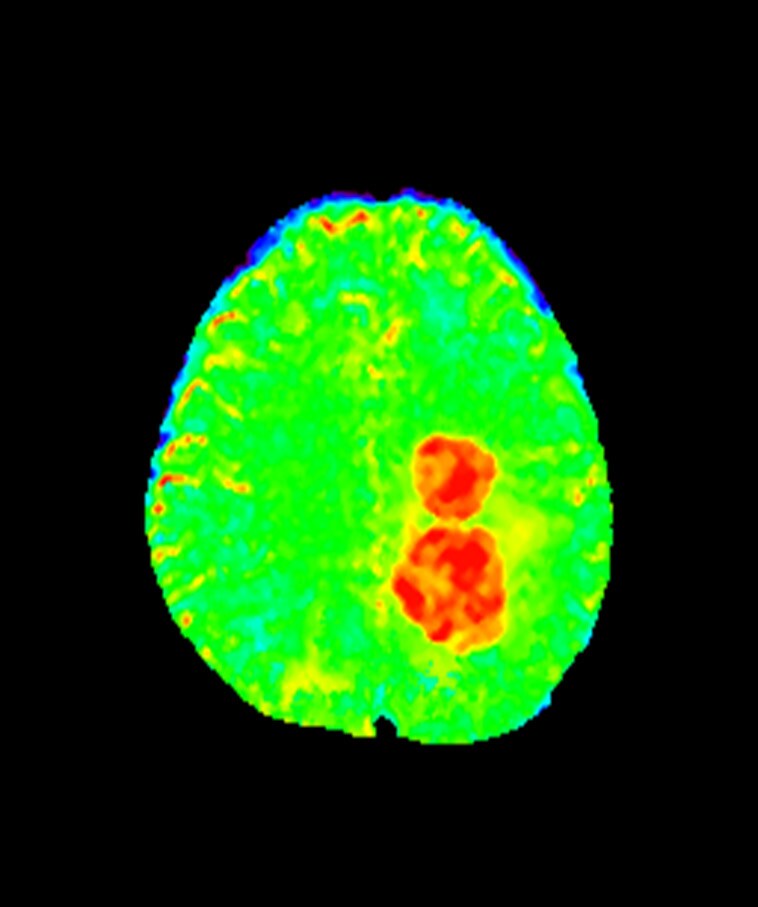
Формирование изображений. APT карта.
Для построения APT карт собираются и отстраиваются девять изображений (показаны голубыми точками) с различными частотами селективного преднасыщающего импульса (рис.7.). Восемь из них (1-8) используются непосредственно для расчета APT карты аналогично построению 〖MTR〗_asym спектра, девятое (9), полученное в дальней области спектра, используется для нормировки. В точке 3.5ppm Z-спектра получают не одно, а три изображения (1-3), которые используются для построения B0 карты с помощью алгоритма Philips mDIXON. В дальнейшем B0 карта используется для введения поправок на неоднородность поля, которая может приводить к сдвигам частот в Z-спектре в различных вокселях. В результате производится коррекция изображений из разных областей Z спектра, формирующих повоксельно финальную APT карту, что позволяет получать более достоверные и точные результатам. Пример получаемой карты APT представлен на рисунке 7.
Клинические приложения APT визуализации.
Интенсивность каждого пиксела карты APT, представленной на рисунке 8. пропорциональна концентрации эндогенных клеточных белков. Именно поэтому наибольшую эффективность данная методика имеет в онковизуализации. Так, согласно большому количеству исследований, агрессивные высокопролиферативные опухолевые ткани отличаются повышенными уровнями белков и пептидов. Более того их содержание коррелирует с грейдами, которые оцениваются по патологическим признакам, определенным Всемирной организацией здравоохранения (WHO grade) [8]. На данный момент существует два основных способа применения APT в клинической практике – оценка злокачественности образования и контроль эффективности терапии.
APT для оценки злокачественности опухолей
Количество работ по использованию APT в клинической практике для дифференциальной диагностики злокачественности тех или иных новообразований в головном мозге с каждым годом только увеличивается. Весьма многообещающими являются результаты иccледования [7], в котором показана эффективность количественного анализа APT карт в дифференциации глиом низкого грейда от высокого грейда (-1,61 (SDs – стандартное отклонение), p <0,001). При этом обнаруживаются достоверные различия даже между II и III грейдами (-1,83 SDs, p = 0,005), и между 2 грейд от 4 грейда (-2,34 SDs, p < 0,001). В качестве референсных значений в таких исследованиях выступают результаты гистопатологического исследования. Также в работе [8] проводилось исследование 26 пациентов с низким грейдом глиом и 25 человек с высоким грейдом на аппарате Achieva 3.0 T; Philips Medical Systems, Best, the Netherlands методами APT. В результате было показано, что значения интенсивностей на картах APT были значительно выше (p<0.001) в группе с высоким грейдом. Аналогичные результаты были получены и в других исследованиях [9,10]: сигнал в глиомах высоких грейдов достоверно выше, чем в низких.
Приведем несколько примеров:
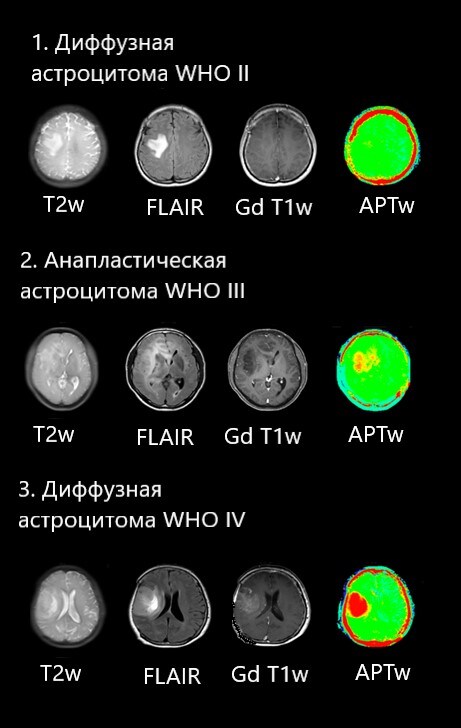
1) Пациент 38 лет с подтвержденной диффузной астроцитомой, 2 грейд по классификации ВОЗ. На данных изображениях как рутинной МРТ так и на APT наблюдается картина опухоли низкой злокачественности – при такой картине на APT картах мы не видим более ярких участков на фоне остальных тканей мозга.
2) Пациент 47 лет с подтвержденной анапластической астроцитомой, 3 грейд по классификации ВОЗ. Отсутствие контрастного усиления в опухоли в данном случае не дает с уверенностью говорить о ее злокачественности, однако в данном случае на APT картах наблюдаются области повышенного сигнала в ядре опухоли, что подтверждает ее высокую пролиферативную активность, которая коррелирует со степенью злокачественности.
3) Пациент с глиобластомой, 4 грейд по классификации ВОЗ. По всем сигнальным характеристикам стандартных импульсных последовательностей данная опухоль имеет высокую степень злокачественности. При этом APT карты дают нам дополнительную информацию о том, что материал для биопсии можно получить из любого участка солидного компонента опухоли.
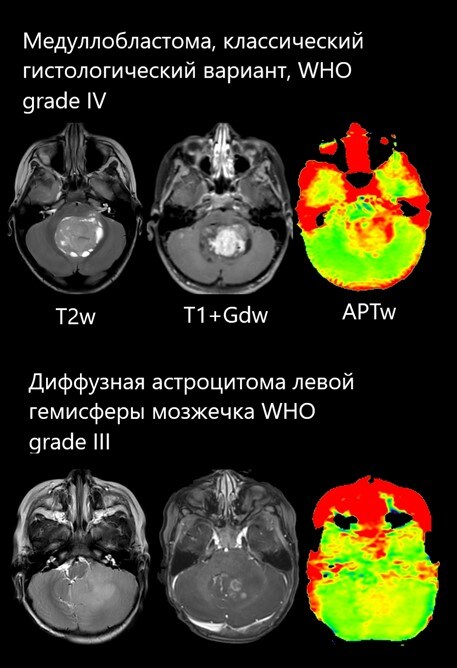
1) Пациент -ребёнок 8 лет с медуллобластомой (классический гистологический вариант), 4 грейд по классификации ВОЗ. На APT катах определяется высокий сигнал по всему объёму опухоли, отражающий высокую ее пролиферативную активность.*
2) Пациент - ребёнок 12 месяцев с диффузной астроцитомой левой гемисферы мозжечка), 3 грейд по классификации ВОЗ. Cигнал от опухолевой инфильтрации на APT картах гетерогенный, а наиболее интенсивные показатели регистрируются в зонах наивысшей анаплазии. При этом большая часть опухоли является контраст-негативной.*
* Данные предоставлены сотрудниками ГБУЗ «Морозовская ДГКБ ДЗМ, г.Москва).
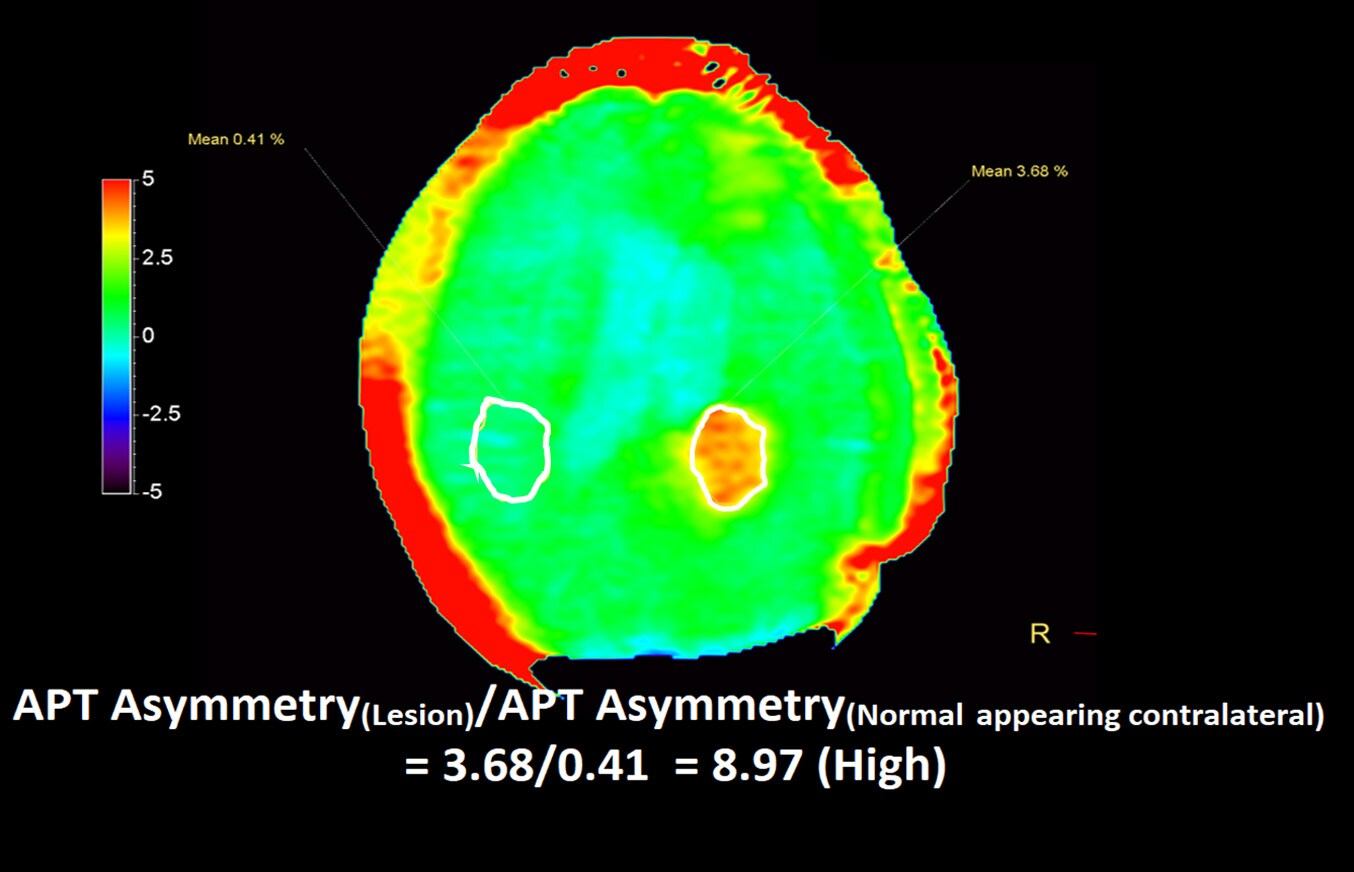
Для возможности количественно анализа APT изображений, часто проводят измерения отношения интенсивности сигнала непосредственно в области его повышения к интенсивности нормальных тканей в контралатеральных областях.
APT для оценки эффективности терапии опухолей
Помимо задач дифференциальной диагностики злокачественности опухолей, в клинической практике крайне неободимо иметь инструмент позволяющий оценивать ответ опухоли на проводимое лечения: визуализация остаточной опухоли после хирургического лечения, мониторинг ответа опухоли на лучевую или химиотерапию. Проведение такого контроля на каждом этапе лечения увеличивает ее эффективность. Согласно множеству опубликованных результатов методика APT отлично подходит для этой задачи.
Так к примеру, Zhou et al. 11 показали, что участки с лучевым некрозом имеют гипо- или изоинтенсивный сигнал на APT-картах в сравнении с нормальной паренхимой головного мозга. Низкий сигнал на APT-картах связан с тем, что зоны некроза лишены нормальной цитоархитектоники, в которых отсутствуют мобильные цитозольные белки. На контрольных МР-исследованиях, проводимых для оценки эффективности лучевой терапии опухолей головного мозга, отмечалось увеличение площади патологического сигнала на T2-ВИ изображениях, в то время как сигнал на APT-картах уменьшался, что позволяло интерпретировать данную картину как проявления лучевого некроза, свидетельствующего об эффективном лечении.
[Это и дальнейшие исследования показали, что APT является уникальным методом визуализации при оценки ответа опухоли на лучевую и химиотерапию 12–14 , а также при терапии высокоинтенсивным фокусированным ультразвуком 15. Также несколько клинических исследований подтвердили возможность c помощью методов APT дифференцировать прогрессию от псевдопрогрессии 16–20. Данные результаты демонстрируют потенциал визуализации APT в нейроонкологии как неинвазивного биомаркера активного опухолевого процесса.
Приведем несколько клинических кейсов:
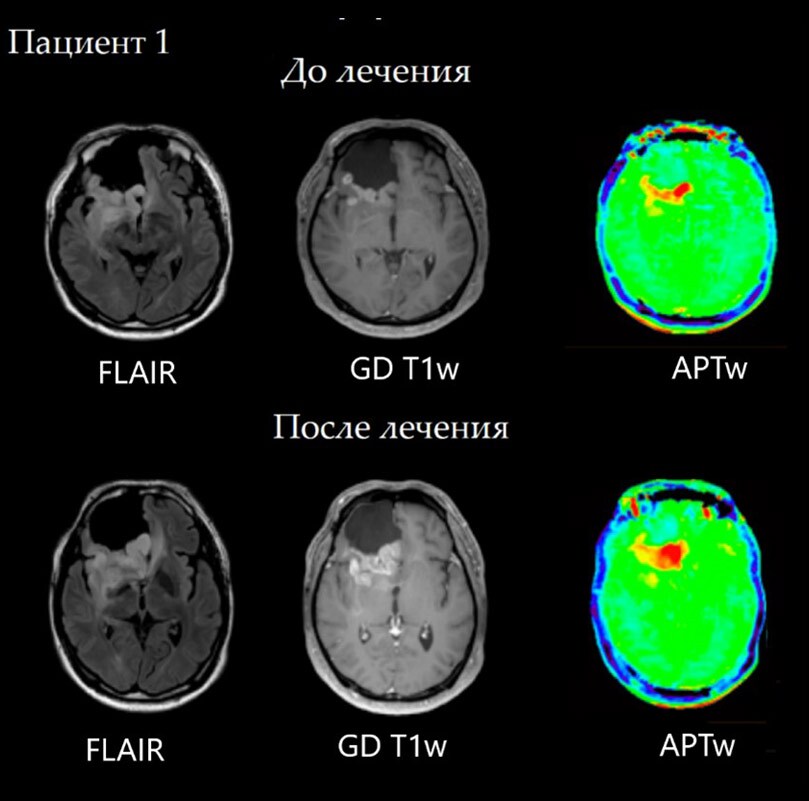
Случай №1 Пациент с анапластической астроцитомой правой лобной доли. На контрольной визуализации после хирургического лечения по задней границе резекции определяется участок патологического сигнала, в котором отмечается как накопление контраста, так и повышение сигнала на APT-картах, что говорит об остаточной опухолевой инфильтрации. При динамическом контроле, к сожалению, мы наблюдаем не эффективность проводимой химиотерапии, ввиде продолженного роста опухоли и увеличение области повышенного сигнала на APT-картах почти в 2 раза.
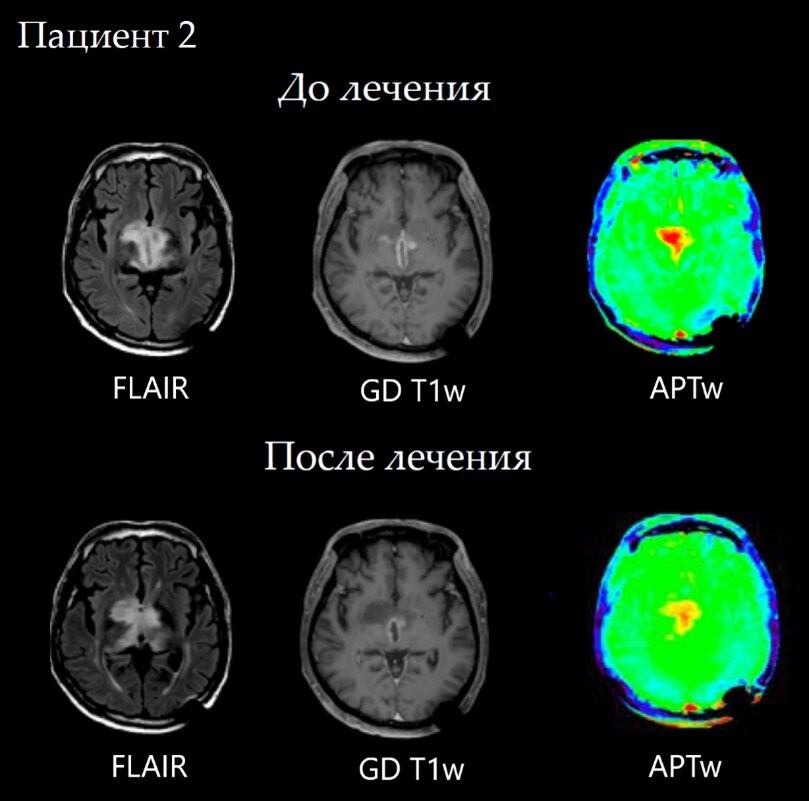
Случай №2 Пациент с биталамической глиобластомой- на контрольном МР-исследовании после проведенного лечение, на изображениях FLAIR и постконтрастных T1-ВИ без явной положительной динамики. Однако на АPT-картах определяется выраженное уменьшение интеснивности сигнала, что говорит о положительном терапевтическом эффекте.
* Данные предоставлены сотрудниками ГБУЗ «Морозовская ДГКБ ДЗМ, г.Москва).
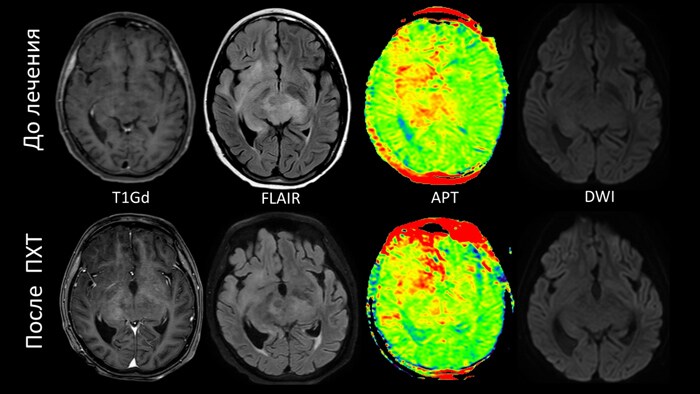
Пациент - ребёнок 11 лет с биталамической анапластической астроцитомой, 4 грейд по классификации ВОЗ. После нескольких курсов химиотерапии отмечается уменьшения патологического сигнала от всего объема опухолевой инфильтрации на Flair изображениях. При этом на АPT-картах визуализируется уменьшение сигнала только от таламусов, а от базальных ядер справа интенсивность сигнала увеличилась, что свидетельствует об сохраняющейся активной опухолевой пролиферации и частичном ответе на проводимое лечение. В данном случае мониторинг эффективности химиотерапии был возможен только по APT-визуализации, поскольку опухолевая инфильтрация являлась тотально контраст-негативной и не ограничивала диффузию.
Другие приложения APT в неврологии и нейровизуализации.
Ишемический инсульт
Другой задачей нейровизуализации, в которой APT может дать дополнительную информацию, является диагностика ишемического инсульта. Современные методы лечения ишемического инсульта рекомендуют скорейшее восстановление кровоснабжение к ишемизированным жизнеспособным тканям21. Данные области называют «ишемической полутенью» или «пенумброй». При стандартном МР-исследовании несоответствие между патологическими зонами на диффузионно-взвешенных изображениях (DWI) и перфузионно-взвешенных изображениях (PWI) давно уже считается маркером для идентификации участков «ишемической полутени». Однако, этот метод часто приводит к ошибкам при наличии в зоне интереса доброкачественной олигемии] 22,23
Основным маркером, указывающим на недостаточный приток крови к ткани, является закисление внутриклеточной среды в результате активации анаэробной стадии гликолиза при недостатке кислорода, поступающего с кровью 24. Таким образом pH чувствительное APT может стать одним из методов диагностики ишемического инсульта. Zhou et al. 25 впервые продемонстрировали существование pH-чувствительных эффектов APT при ишемии на модельных животных в 2003 году. Они обнаружили снижение MTRasym (3,5 ppm) в посмертном мозге крыс с глобальной ишемией. Используя P^31спектроскопию для оценки pH, они отнормировали значения APT, получив изображения, взвешенные по pH (pHw). Чувствительность APT к значениям pH внутриклеточной среды обусловлена тем, что частота протонирования и депротонирования амино- и амидо- групп в значительной степени чувствительна к кислотности внутриклеточной среды (pH). Эти многообещающие результаты стимулировали внедрение этого метода в клиническую практику 26–29. Например, в 27 исследовании 12 пациентов с острым ишемическим инсультом Harston et al. показали, что в вокселах ишемического ядра наблюдается более сильный внутриклеточный ацидоз (повышение pH), чем в гипоперфузированной ткани, задействованной в последнем инфаркте (ишемическая полутень), которая, в свою очередь, была более ацидозной (закисленной), чем сохранившаяся гипоперфузированная ткань (доброкачественная олигемия).
Болезнь Альцгеймера
Другой областью применения технологии APT является диагностика болезни Альцгеймера (БА), которая представляет собой возрастное необратимое заболевание головного мозга, характеризующееся накоплением внеклеточных амилоидных бляшек и внутриклеточных нейрофибриллярных клубков. В недавнем исследовании Wang et al.30 проверили возможности APT визуализации для обнаружения церебральных аномалий у пациентов с БА и для дифференцировки пациентов с разной степенью тяжести заболевания. APT гиппокампа показала устойчивую тенденцию к увеличению гиперинтенсивности APT при увеличении степени тяжести БА. Значения APT достоверно отрицательно коррелировали с оценками психического состояния (MMSE) (r = -0,602, P <0,001). Эти предварительные результаты предполагают, что APT может быть полезной для выявления ранней БА и неинвазивного мониторинга прогрессирования заболевания.
Болезнь Паркинсона
Болезнь Паркинсона (БП) - нейродегенеративное заболевание, характеризующееся пониженным уровнем дофамина в дофаминергических нейронах черной субстанции 31. Диагностика БП, особенно на ранней стадии, остается сложной задачей. Li et al. 32 проверили возможности APT визуализации у пациентов с БП при напряженности поля 3Т (Magnetic Resonance Imaging). В областях черного вещества и красного ядра интенсивность сигнала APT была снижена у пациентов по сравнению с контрольной группой. Более того, у пациентов с БП с односторонними симптомами, интенсивность APT в черной субстанции на пораженной стороне была значительно ниже, чем там же в контрольной группе 33.
Связанные решения
-
DWI TSE
Приложение DWI TSE позволяет выполнять диффузионную визуализацию с превосходными характеристиками отношения «сигнал/шум» и резкости, а также сниженным уровнем геометрического искажения*, особенно для сложных анатомических структур, таких как внутреннее ухо.
NMRB510 -
mDIXON Quant
Приложение mDIXON Quant обеспечивает быстрое и удобное выполнение неинвазивного количественного анализа жировой ткани печени в режиме 3D, предоставляя трехмерные карты жировой фракции всей печени высокого качества с высоким уровнем точности (±3,5%) и воспроизводимости (±1,4%)¹ даже при коротком T2*, позволяя расширить возможности МРТ. Для облегчения диагностики предоставляются карты релаксации T2*/R2*.
NMRB462
Регистрационное удостоверение №ФСЗ 2009/04509 Томограф магнитно-резонансный Achieva с принадлежностями.
Статья подготовлена совместно с коллективом ГБУЗ «Морозовская ДГКБ ДЗМ, г.Москва
Список использованной литературы:
[1] Padma Rao, et al. Role of MRI in paediatric neurooncology. Eur J Radiol. 2008;68(2):259-270. doi:10.1016/J.EJRAD.2008.06.033
[2] Kyle M Jones, et al. Clinical applications of chemical exchange saturation transfer (CEST) MRI. J Magn Reson Imaging. 2018;47(1):11-27. doi:10.1002/JMRI.25838
[3] Sander Brinkhof, et al. Detection of early cartilage damage: feasibility and potential of gagCEST imaging at 7T. Eur Radiol. 2018;28(7):2874-2881. doi:10.1007/S00330-017-5277-Y
[4] Gizeaddis Lamesgin Simegn, et al. Repeatability and reproducibility of prospective motion- and shim corrected 2D glycoCEST MRI. Quant Imaging Med Surg. 2019;9(10):1674-1685. doi:10.21037/QIMS.2019.09.15
[5] Yanlong Jia, et al. Glutamate Chemical Exchange Saturation Transfer (GluCEST) Magnetic Resonance Imaging in Pre-clinical and Clinical Applications for Encephalitis. Front Neurosci. 2020;14. doi:10.3389/FNINS.2020.00750
[6] Z Jinyuan Zhou, et al. APT-Weighted MRI: Techniques, Current Neuro Applications, and Challenging Issues. J Magn Reson Imaging. 2019;50(2):347. doi:10.1002/JMRI.26645
[7] Bisdas Sotirios, et al. The role of APT imaging in gliomas grading: A systematic review and meta-analysis. Eur J Radiol. 2020;133. doi:10.1016/J.EJRAD.2020.109353
[8] Tianyu Zou, et al. Differentiating the histologic grades of gliomas preoperatively using amide proton transfer-weighted (APTW) and intravoxel incoherent motion MRI. NMR Biomed. 2018;31(1). doi:10.1002/NBM.3850
[9] Yan Bai, et al. Noninvasive amide proton transfer magnetic resonance imaging in evaluating the grading and cellularity of gliomas. Oncotarget. 2017;8(4):5834-5842. doi:10.18632/ONCOTARGET.13970
[10] Akihiko Sakata, et al. Grading glial tumors with amide proton transfer MR imaging: different analytical approaches. J Neurooncol. 2015;122(2):339-348. doi:10.1007/S11060-014-1715-8
[11] Jinyuan Zhou, et al. Differentiation between glioma and radiation necrosis using molecular magnetic resonance imaging of endogenous proteins and peptides. Nat Med. 2011;17(1):130-134. doi:10.1038/NM.2268
[12] Koji Sagiyama, et al. In vivo chemical exchange saturation transfer imaging allows early detection of a therapeutic response in glioblastoma. Proc Natl Acad Sci U S A. 2014;111(12):4542-4547. doi:10.1073/PNAS.1323855111
[13] Xiaohua Hong, et al. Quantitative multiparametric MRI assessment of glioma response to radiotherapy in a rat model. Neuro Oncol. 2014;16(6):856-867. doi:10.1093/NEUONC/NOT245
[14] Silun Wang, et al. Assessment of MRI parameters as imaging biomarkers for radiation necrosis in the rat brain. Int J Radiat Oncol Biol Phys. 2012;83(3). doi:10.1016/J.IJROBP.2011.12.087
[15] Stefanie J.C.G. Hectors, et al. Amide proton transfer imaging of high intensity focused ultrasound-treated tumor tissue. Magn Reson Med. 2014;72(4):1113-1122. doi:10.1002/MRM.25000
[16] Kimberly L Desmond, et al. Chemical exchange saturation transfer for predicting response to stereotactic radiosurgery in human brain metastasis. Magn Reson Med. 2017;78(3):1110-1120. doi:10.1002/MRM.26470
[17] Kye Jin Park, et al. Added value of amide proton transfer imaging to conventional and perfusion MR imaging for evaluating the treatment response of newly diagnosed glioblastoma. Eur Radiol. 2016;26(12):4390-4403. doi:10.1007/S00330-016-4261-2
[18] Ji Eun Park, et al. Pre- and Posttreatment Glioma: Comparison of Amide Proton Transfer Imaging with MR Spectroscopy for Biomarkers of Tumor Proliferation. Radiology. 2016;278(2):514-523. doi:10.1148/RADIOL.2015142979
[19] Bo Ma, et al. Applying amide proton transfer-weighted MRI to distinguish pseudoprogression from true progression in malignant gliomas. J Magn Reson Imaging. 2016;44(2):456-462. doi:10.1002/JMRI.25159
[20] Shanshan Jiang, et al. Identifying Recurrent Malignant Glioma after Treatment Using Amide Proton Transfer-Weighted MR Imaging: A Validation Study with Image-Guided Stereotactic Biopsy. Clin Cancer Res. 2019;25(2):552-561. doi:10.1158/1078-0432.CCR-18-1233
[21] Schmiedek P, et al. Microsurgery for Stroke. 1977.
[22] Richard Leigh, et al. Imaging the physiological evolution of the ischemic penumbra in acute ischemic stroke. J Cereb Blood Flow Metab. 2018;38(9):1500-1516. doi:10.1177/0271678X17700913
[23] S Warach, et al. Clinical outcome in ischemic stroke predicted by early diffusion-weighted and perfusion magnetic resonance imaging: a preliminary analysis. J Cereb Blood Flow Metab. 1996;16(1):53-59. doi:10.1097/00004647-199601000-00006
[24] Jinyuan Zhou, et al. Defining an Acidosis-Based Ischemic Penumbra from pH-Weighted MRI. Transl Stroke Res. 2011;3(1):76-83. doi:10.1007/S12975-011-0110-4
[25] Jinyuan Zhou, et al. Using the amide proton signals of intracellular proteins and peptides to detect pH effects in MRI. Nat Med. 2003;9(8):1085-1090. doi:10.1038/NM907
[26] Guodong Song, et al. Evolution of Cerebral Ischemia Assessed by Amide Proton Transfer-Weighted MRI. Front Neurol. 2017;8(MAR). doi:10.3389/FNEUR.2017.00067
[27] George W J Harston, et al. Identifying the ischaemic penumbra using pH-weighted magnetic resonance imaging. Brain. 2015;138(Pt 1):36-42. doi:10.1093/BRAIN/AWU374
[28] Anna Tietze, et al. Assessment of ischemic penumbra in patients with hyperacute stroke using amide proton transfer (APT) chemical exchange saturation transfer (CEST) MRI. NMR Biomed. 2014;27(2):163-174. doi:10.1002/NBM.3048
[29] Xuna Zhao, et al. Saturation power dependence of amide proton transfer image contrasts in human brain tumors and strokes at 3 T. Magn Reson Med. 2011;66(4):1033-1041. doi:10.1002/MRM.22891
[30] Caixia Wang, et al. Malate-aspartate shuttle mediates the intracellular ATP levels, antioxidation capacity and survival of differentiated PC12 cells. Int J Physiol Pathophysiol Pharmacol. 2014;6(2):109-114. www.ijppp.org. Accessed October 23, 2021.
[31] William Dauer, et al. Parkinson’s disease: mechanisms and models. Neuron. 2003;39(6):889-909. doi:10.1016/S0896-6273(03)00568-3
[32] Chunmei Li, et al. Chemical exchange saturation transfer MR imaging of Parkinson’s disease at 3 Tesla. Eur Radiol. 2014;24(10):2631-2639. doi:10.1007/S00330-014-3241-7
[33] Chunmei Li, et al. Chemical Exchange Saturation Transfer MRI Signal Loss of the Substantia Nigra as an Imaging Biomarker to Evaluate the Diagnosis and Severity of Parkinson’s Disease. Front Neurosci. 2017;11(AUG). doi:10.3389/FNINS.2017.00489