Методика SWIp, позволяющая выявлять внутрисосудистую венозную деоксигенированную кровь и экстраваскулярные продукты распада крови, по праву является неотъемлемой частью протоколов визуализации при острой травме и сосудистой патологии центральной нервной системы, в том числе как часть первичной диагностики при невозможности выполнения исследования с применением внутривенных контрастных препаратов. Наш опыт показал, что SWIp в сочетании с современными методами ускоренного сбора данных может использоваться в составе рутинного протокола исследования, как у взрослых, так и у детей, без существенного увеличения продолжительности сканирования”.
Мельников Илья Андреевич,
к.м.н., заведующий отделением магнитно-резонансной и компьютерной томографии НИИ Неотложной Детской Хирургии и Травматологии
Магнитно-резонансная томография (МРТ) играет важную роль в диагностике неврологических заболеваний. Классические последовательности, применяемые в клинической практике, отражают такие ключевые параметры тканей, как: времена релаксации T1, T2 и T2*, измеряемый коэффициент диффузии и протонную плотность. Широко применяются последовательности, взвешенные по T1 и T2, инверсия-восстановление с подавлением воды (FLAIR) и диффузионная МРТ (рис. 1).
В настоящее время также активно развиваются методики для оценки магнитной восприимчивости, которая отражает содержание магнетиков в биологических тканях. К этим методам относятся изображения, взвешенные по магнитной восприимчивости (Susceptibility weighted imaging with phase enhancement, SWIp) и количественное картирование магнитной восприимчивости (Quantitative susceptibility mapping, QSM). Эти сравнительно новые типы взвешенности значительно отличаются от вышеупомянутых методик и обладают высокой чувствительностью к магнитной восприимчивости, даже по сравнению с последовательностями, взвешенными по T2* [1]. Количественное картирование магнитной восприимчивости чаще всего используется для определения содержания железа в базальных ганглиях на фоне нейродегенеративных заболеваний [2], в то время как изображения, взвешенные по магнитной восприимчивости, нашли более широкое клиническое применение при диффузно-аксональном повреждении головного мозга.
Физические основы получения изображений, взвешенных по магнитной восприимчивости:
Вещества, обладающие магнитными свойствами, будучи помещенными во внешнее магнитное поле B0, изменяют его значение на величину ∆B=∆χ* B0 за счет того, что магнитная восприимчивость магнетиков и окружающих тканей отличается на ∆χ. Вещества, для которых ∆χ<0 (например ферритин и гемосидерин) являются парамагнитными и увеличивают значение магнитного поля. Для диамагнетиков (кальций) ∆χ>0, локальное значение поля уменьшается. Так как частота прецессии протонов пропорциональна величине внешнего магнитного поля, между протонами в областях с различным содержанием магнетиков накапливается разность фаз [3].
принципиальное преимущество метода SWIp по отношению к T2*-взвешенным изображениям - использование фазовых данных для повышения первоначального контраста магнитудных изображений”.
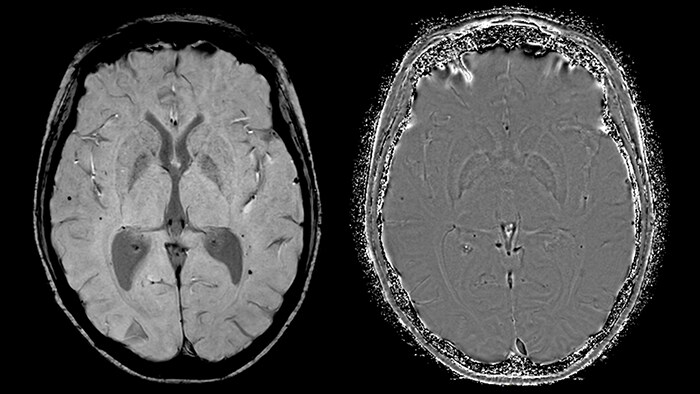
Присутствие парамагнитных веществ будет приводить к появлению областей с отрицательным значением фазы, диамагнитных – с положительным. Значение накопленной фазы регистрируется на так называемых фазовых изображениях, которые используются для создания изображений, взвешенных по магнитной восприимчивости. Вне зависимости от знака фазы происходит дефазировка протонов и спад сигнала, поэтому на обычном, магнитудном изображении, области, содержащие пара- и диамагнетики, гипоинтенсивны. На фазовых же изображениях отложения железа гипоинтенсивны, в то время как кальцификации гиперинтенсивны, что может быть крайне полезно при диагностике.
Получение изображений, взвешенных по магнитной восприимчивости: импульсная последовательность
SWIp использует последовательность мультиградиентного эха (рис.2) с малым значением угла переворота (FA) и короткими временами повторения (TR) и первого эха (TE). Для достижения оптимального контраста эффективное время эхо - около 40 мс для 1.5 Тл и 20 мс на 3 Тл [4]. Количество эхо-сигналов за один TR ограничено T2* спадом сигнала и, как правило, составляет 3-4; использование нескольких эхо позволяет улучшить отношение сигнал/шум.
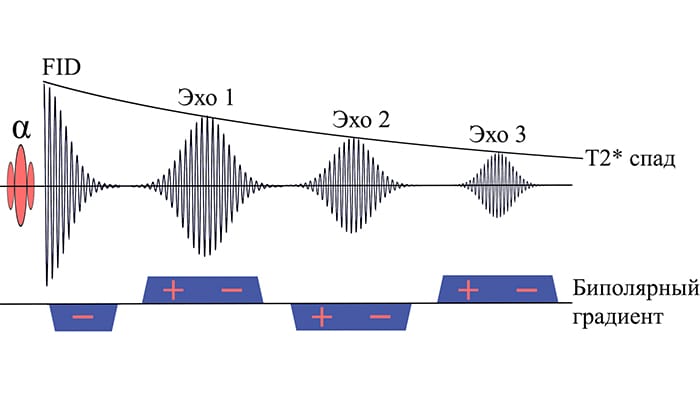
При этом высокий контраст сосудов на ранних эхо достигается благодаря феномену времени пролета (втеканию в срез протонов с высокой продольной намагниченностью, дающих высокий сигнал), в то время как контраст поздних эхо обусловлен в основном накопленной разностью фаз, которая отражает содержание магнетиков в тканях [5].
Ключевая черта последовательности SWIp – переключение полярности градиента магнитного поля [6], призванное скомпенсировать разность фаз, возникающую между стационарными и подвижными протонами. Под действием градиента неподвижные протоны накапливают фазу, пропорциональную времени приложения градиента и его амплитуде. Как следствие, использование одинаковых градиентов с разными знаками не приведет к изменению фазы неподвижных протонов (рис.3, слева).
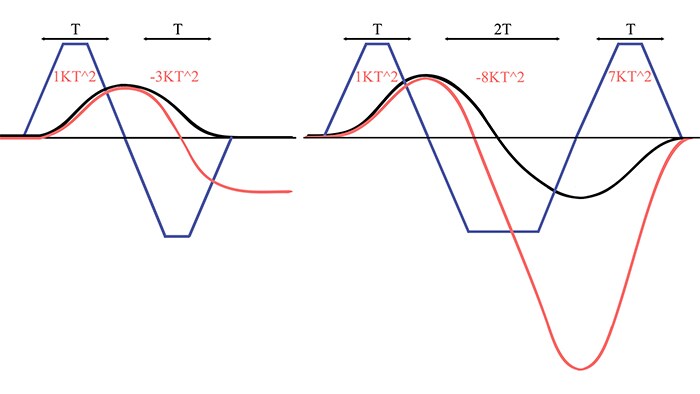
Фаза движущихся же протонов пропорциональна квадрату времени приложения градиента [7]. Как видно на левой части рисунка 3, между подвижными и стационарными протонами накапливается разность фаз - происходит дефазировка протонов, вызывающая спад сигнала и артефакты потока. Для их предотвращения в последовательности SWIp используется видоизменный вид градиента (рис.3, справа), компенсирующий возникновение разности фаз и дефазировку.
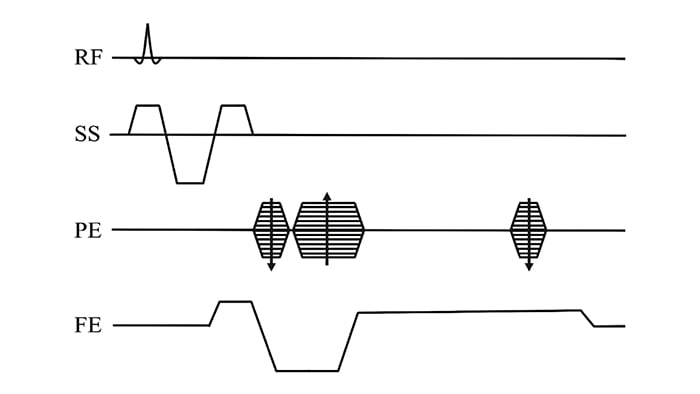
На рисунке 4 представлена схематичная диаграмма импульсной последовательности некогерентного градиентного эха, в которой вышеописанный принцип компенсации разности фаз между протонами реализован вдоль каждой из трех осей пространственного кодирования. Градиент частотного кодирования также используется для считывания эхо-сигнала и градиентного искажения остаточной продольной намагниченности в конце каждого TR.
Получение изображений, взвешенных по магнитной восприимчивости: алгоритм реконструкции изображений
При сканировании получают обычное, магнитудное изображение, обладающее смешенным контрастом, а также фазовое, яркость пикселей которого зависит от накопленной протонами разности фаз, лежащей в пределе от -180 до 180 градусов.
Фазовое изображение подвергается действию высокочастотного фильтра, который исключает компоненты с низкой пространственной частотой, что уменьшает вклад неоднородностей внешнего магнитного поля и неоднородностей, возникающих на границе между воздухом и тканями.
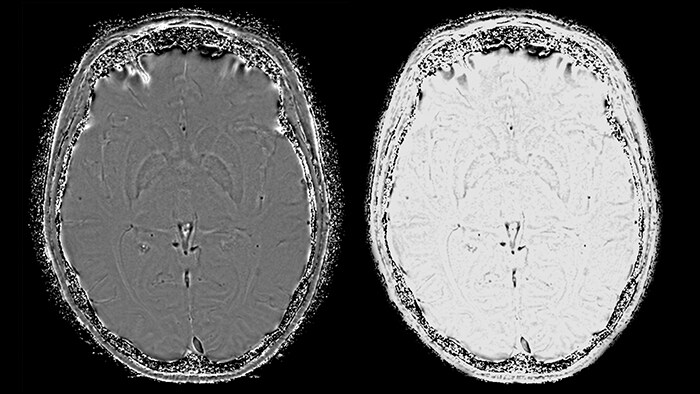
Отфильтрованное фазовое изображение не только используется для дальнейшего процесса реконструкции, но и сохраняется для использования в диагностических целях наряду с финальным SWI изображением. Затем на основании обработанного фазового изображения строится фазовая маска (рис.5), которая ставит каждому значению накопленной разности фаз в соответствие число от 0 до 1 – значение фазовой маски.
SWI изображения получают путем многократного (3-4) умножения фазовой маски на магнитудное изображение. При этом сигнал от областей с фазой, соответствующей малому значению фазовой маски, будет наиболее подавлен, а области со значением фазовой маски 1 не будут подавлены вовсе, что значительно повысит первоначальный контраст. Фазовая маска позволяет увеличить контраст лишь областей, содержащих парамагнетики (для лучшей визуализации вен, микрокровоизлияний и пр.), или же только диамагнитных областей, соответствующих отложению кальция. В первом случае интересующие нас значения фазы отрицательны, поэтому значение маски f в точке х рассчитывается следующим образом [8]:
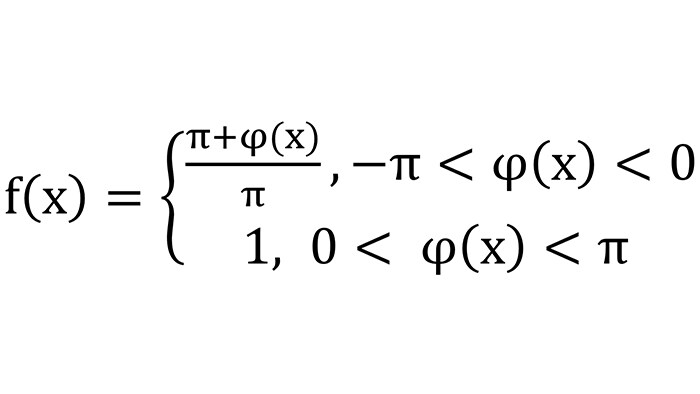
Умножение этой маски на магнитудное изображение никак не повлияет на области с положительной накопленной фазой, но повысит контрастность областей с повышенным содержанием парамагнитного железа. Конечный результат последовательности SWIp – SWI- и отфильтрованное фазовое изображение (рис. 6), обладающие уникальным контрастом, при этом первое отражает как локальные изменения магнитной восприимчивости тканей, так и значение амплитуды МР-сигнала. Таким образом, принципиальное преимущество метода SWIp по отношению к T2*-взвешенным изображениям - использование фазовых данных для повышения первоначального контраста магнитудных изображений. Это обуславливает более высокую диагностическую ценность этой методики по сравнению с T2* последовательностями [9].
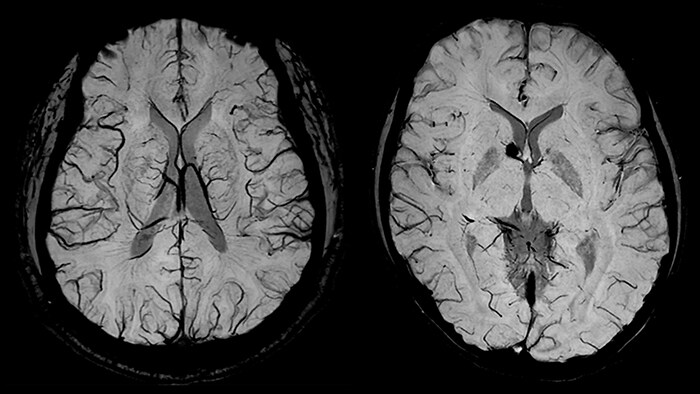
Как правило, для просмотра этих изображений применяется метод проекции минимальной интенсивности (Minimum intensity projection, mIP). Используется информация из срезов в определенном объеме толщиной до 10 мм [10], причем для построения mIP из каждого среза выбираются наименее интенсивные области. Такой способ отображения SWI изображений упрощает визуализацию гипоинтенсивных структур, таких как парамагнитные вены.
Клинические применения метода SWIp
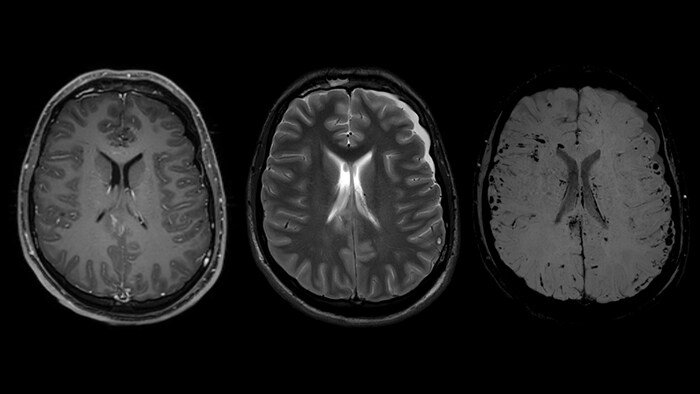
SWIp активно используется для визуализации точечных кровоизлияний в глубоком подкорковом белом веществе, которые сопровождают диффузные аксональные повреждения головного мозга. Клинический прогноз зависит от числа кровоизлияний, а недавнее исследование [11] выявило связь между кровоизлияниями в ряде глубоких подкорковых областей головного мозга и повышенной вероятностью нарушения исполнительных функций у подростков. Таким образом, остро стоит необходимость обнаружения и точной локализации церебральных микрокровоизлияний [12]. Эти точечные патологические изменения при диффузно-аксональном повреждении не столь заметны при использовании традиционных методик МРТ-визуализации (рис.8). Использование фазовой информации обуславливает более высокий контраст кровоизлияний на SWI изображениях, как следствие, даже чувствительные к неоднородностям поля T2* последовательности уступают SWI изображениям по чувствительности при диагностике диффузных аксональных повреждений [13].
В настоящее время основная цель терапии ишемического инсульта – ткани, находящиеся в состояние гипоксии вследствие локального нарушения кровоснабжения. Эта так называемая область ишемической полутени (пенумбры), содержит ишемизированные, но еще жизнеспособные ткани. В связи с этим для улучшения исхода заболевания крайне важна своевременная диагностика и раннее начало лечения. Для определения области пенумбры традиционно применяется комбинация двух МРТ методик: диффузионно-взвешенные изображения (Diffusion-weighted imaging, DWI) и перфузионно-взвешенные изображения (Perfusion-weighted imaging, PWI). Ишемическая полутень соответствует области перфузионно-диффузионного несоответствия патологических зон на DWI и PWI изображениях [14].
Исследование Bhattacharjee et al. [15] показало, что комбинация DWI и SWI изображений позволяет точно определить область пенумбры благодаря высокому эндогенному контрасту расположенных в ней вен. Так как ишемический инфаркт сопровождается повышенным значением фракции экстракции кислорода, концентрация парамагнитного дезоксигемоглобина в этих венах увеличивается [16]. Как следствие, на SWI изображениях вены в области пенумбры гипоинтенсивны, что указывает на ишемизированные жизнеспособные ткани.
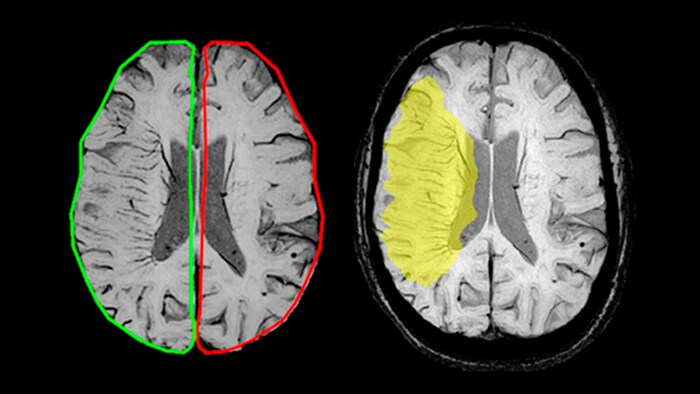
Согласно результатам вышеупомянутой работы, DWI-SWI столь же эффективен, как PWI-DWI, и позволяет сократить времена сканирования на 17%. К другим ключевым преимуществам использования методики SWIp в сочетании с DWI (в качестве альтернативы PWI) относится способность изображений, взвешенных по магнитной восприимчивости, визуализировать вены, в то время как PWI лучше отражает артерии [15]. Столь же важна возможность проведения исследования без введения контрастных агентов, что особенно существенно в случае с пациентами детского возраста и пациентами с нарушением функции почек [17].
Методика SWIp также нашла применение в обнаружении венозных мальформаций в головном мозге, приводящих к уменьшению скорости локального тока крови, а также утечкам кровеносных сосудов. Парамагнитные свойства гемосидерина и дезоксигемоглобина, а также изменение концентрации окси- и дезоксигемоглобина обуславливают высокий контраст кавернозных ангиом и венозных аномалий развития на SWI изображениях.
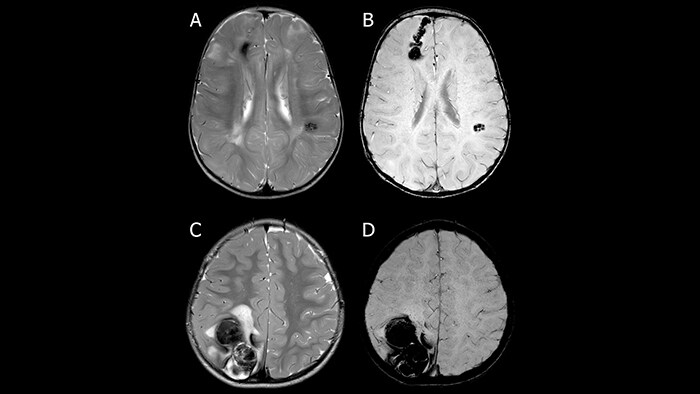
Sparacia et al. показали [18], что изображения, полученные благодаря методике SWIp на МР-томографе Achieva 1.5 Тл, демонстрируют более чем в 2.5 раза больше кавернозных ангиом, чем T2*-взвешенные изображения. При этом авторы отмечают больший размер и более высокую четкость очагов поражения на SWI изображениях, что позволяет выявлять незаметные на T2* изображениях очаги и способствует более точной постановке диагноза.
Венозные аномалии развития - самый распространенный вид аномалий сосудистой системы в головном мозге. ВАР связаны с повышенной вероятностью церебральных кровоизлияний и ишемического инсульта [19]. В связи с этим неинвазивная визуализации ВАР играет важную роль в клинической практике.
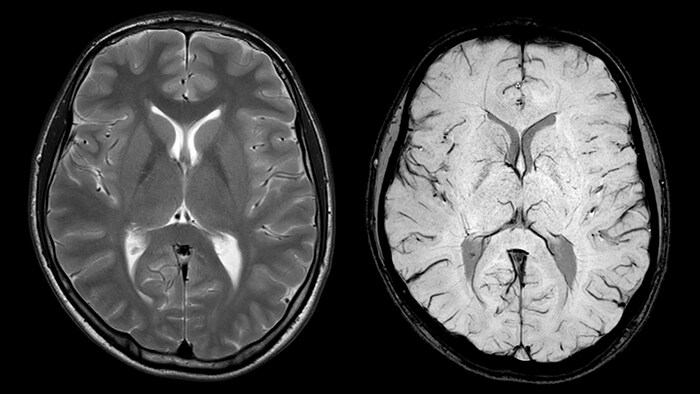
Было показано, что ряд нейродегенеративных заболеваний (в том числе болезни Альцгеймера и Паркинсона) сопровождаются повышенным накоплением железа в сером веществе головного мозга [20,21]. Так, в случае с болезнью Паркинсона, концентрация железа в отдельных структурах головного мозга на 80% выше, чем в норме [22].
Крупные отложения железа в виде ферритина и гемосидерина ускоряют T2* спад сигнала из-за сильных локальных неоднородностей магнитного поля, что приводит к сигналу меньшей интенсивности на магнитудном изображении. Помимо этого, разность фазы, которая накапливается в железосодержащих структурах, обеспечивает высокий контраст на фазовом изображении.
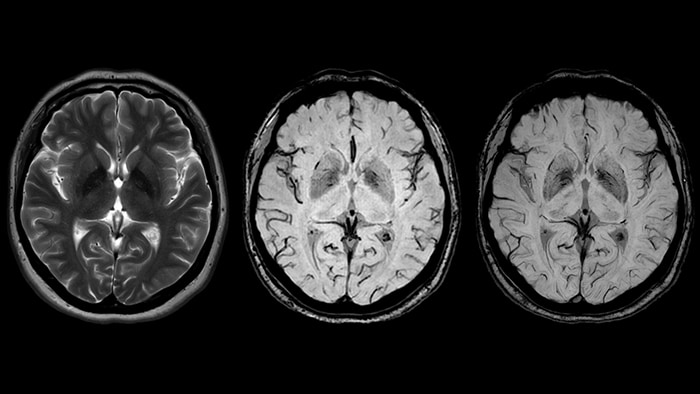
Таким образом, метод SWIp очень эффективен для оценки содержания железа - структуры с его повышенным содержанием будут значительно выделяться по отношению к окружающим тканям. Как следствие, SWIp нашел применение в диагностике нижеприведенных нейродегенеративных заболеваний.
Идиопатическая болезнь Паркинсона (БП), вызванная прогрессивной потерей дофаминергических нейронов в черной субстанции головного мозга, является самым распространенным нейродегенеративным заболеванием. Нигросомы – небольшие группы дофаминергических клеток, в которых наиболее активно протекают процессы нейродегенерации. В диагностике особое внимание уделяется нигросоме-1, содержащей наибольшее количество дофаминергических нейронов. В норме на SWI изображениях она является гиперинтенсивной за счет низкого содержания в ней железа [23] - черная субстанция по форме напоминает хвост ласточки (рис.13, слева).
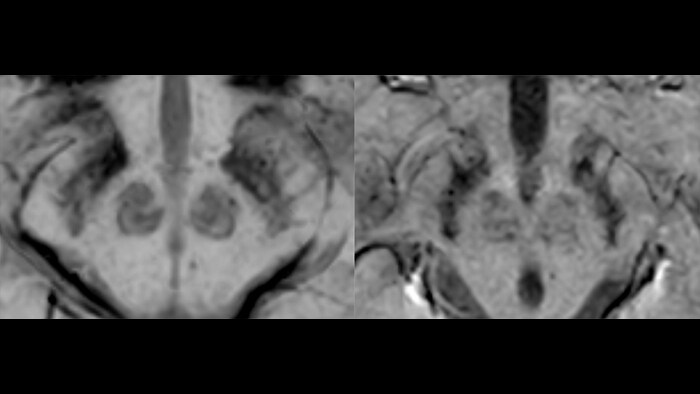
БП сопровождается накоплением железа в нигросоме-1 и снижением сигнала от этой области, “хвост ласточки” изменяется на “запятую” (рис.13, справа), что является маркером данного заболевания [24]. Недавнее исследование Zorzenon et al., использовавшее МР-томограф Achieva 3 Тл, с участием 62 пациентов и здоровых добровольцев показало эффективность использования этого маркера: чувствительность и специфичность составили 91% и 88% соответственно. Более того, значение коэффициента Каппа Коэна, который описывает соглашение между результатами различных экспертов, для SWIp выше, чем у T1- и Т2-взвешенных изображений. Норме соответствовал случай, когда отчетливо видна хотя бы одна из нигросом-1, положительный же диагноз ставился, если нигросома-1 не наблюдалась в одном или обоих полушариях [25]. В исследовании Zhao et al. [26] аналогичная методика использовалась для разделения пациентов с БП и сосудистым паркинсонизмом (СП). БП и СП имеют схожую клиническую картину, однако в силу различной скорости развития патологий для эффективной терапии необходимы маркеры, уникальные для одного из этих заболеваний [27]. Последовательность SWIp может стать одним из основных методов дифференциальной диагностики БП и СП. Так, в вышеупомянутой работе точность и специфичность определения БП по гипоинтенсивности нигросомы-1 (что соответствует отсутствию “хвоста ласточки”) составила 93% и 92%.
Наряду с прогрессирующим супрануклеарным парезом (ПНП) и деменцией с тельцами Леви (ДТЛ) множественная системная атрофия (МСА) относится к самым распространенным формам атипичного паркинсонизма. Более высокий темп нейродегенерации, которым сопровождаются данные заболевания, а также тот факт, что стандартные методы терапии БП не всегда эффективны в случае с ПНП и МСА, обуславливают необходимость их точной дифференциальной диагностики [28].
Стриатонигральная дегенерация (СНД) – одна из форм МСА и вызывает повышенное накопление железа в заднелатеральной скорлупе, которое не так заметно в ПНП и БП. Таким образом, ярко выраженный спад сигнала от этой области на SWI изображениях является маркером СНД. В своей работе Yoon et al. [29] использовали МР-томограф Achieva 3 Тл для оценки гипоинтенсивности скорлупы на и показали высокую эффективность SWI изображений для дифференциальной диагностики СНД и БП.
Связанные продукты
-
32-канальная катушка dStream для головы
Благодаря этой катушке томограф 3,0 Тл с технологией dStream сможет выйти на новый уровень функциональных исследований головного мозга. Эта катушка обеспечивает объемную визуализацию коры головного мозга с высоким разрешением, при этом сохраняя отличное отношение сигнал/шум. Отведения для ЭЭГ можно вывести через отверстие в верхней части катушки.
NMRB375 -
SWIp
Метод SWIp характеризуется высокой чувствительностью к повышению контрастности венозной крови (бедной кислородом) или отложений кальция и при использовании в сочетании с другими медицинскими сведениями может облегчить диагностику различных неврологических патологий. Метод SWIp обеспечивает трехмерную взвешенную по чувствительности визуализацию головного мозга с высоким разрешением, позволяя с легкостью включить его в стандартную практику.
NMRB460
Связанные статьи
Список использованной литературы:
[1] Halefoglu AM, Yousem DM. Susceptibility weighted imaging: Clinical applications and future directions. World J Radiol. 2018;10(4):30-45. doi:10.4329/wjr.v10.i4.30 [2] Langkammer C, Schweser F, Krebs N, et al. Quantitative susceptibility mapping (QSM) as a means to measure brain iron? A post mortem validation study. Neuroimage. 2012;62(3):1593-1599. doi:10.1016/j.neuroimage.2012.05.049 [3] Haller S, Haacke EM, Thurnher MM, Barkhof F. Susceptibility-weighted Imaging: Technical Essentials and Clinical Neurologic Applications. Radiology. 2021;299(1):3-26. doi:10.1148/radiol.2021203071 [4] Haacke EM, Mittal S, Wu Z, Neelavalli J, Cheng YC. Susceptibility-weighted imaging: technical aspects and clinical applications, part 1. AJNR Am J Neuroradiol. 2009;30(1):19-30. doi:10.3174/ajnr.A1400 [5] Verclytte S, Fisch O, Colas L, Vanaerde O, Toledano M, Budzik JF. ASL and susceptibility-weighted imaging contribution to the management of acute ischaemic stroke. Insights Imaging. 2017;8(1):91-100. doi:10.1007/s13244-016-0529-y [6] Sehgal V, Delproposto Z, Haacke EM, et al. Clinical applications of neuroimaging with susceptibility-weighted imaging. J Magn Reson Imaging. 2005;22(4):439-450. doi:10.1002/jmri.20404 [7] McRobbie D, Moore E, Graves M, & Prince M. MRI from Picture to Proton. Cambridge university press. 2017. [8] Haacke EM, Xu Y, Cheng, YC, Reichenbach J. Susceptibility weighted imaging (SWI). Magnetic Resonance in Medicine, 52(3), 2004;612–618. doi:10.1002/mrm.20198 [9] Liu C, Li W, Tong KA, Yeom KW, Kuzminski S. Susceptibility-weighted imaging and quantitative susceptibility mapping in the brain. J Magn Reson Imaging. 2015;42(1):23-41. doi:10.1002/jmri.24768 [10] Gasparotti R, Pinelli L, Liserre R. New MR sequences in daily practice: susceptibility weighted imaging. A pictorial essay. Insights Imaging. 2011;2(3):335-347. doi:10.1007/s13244-011-0086-3 [11] Vander Linden C, Verhelst H, Genbrugge E, et al. Is diffuse axonal injury on susceptibility weighted imaging a biomarker for executive functioning in adolescents with traumatic brain injury? Eur J Paediatr Neurol. 2019;23(3):525-536. doi:10.1016/j.ejpn.2019.04.003 [12] Liu J, Kou Z, Tian Y. Diffuse axonal injury after traumatic cerebral microbleeds: an evaluation of imaging techniques. Neural Regen Res. 2014;9(12):1222-1230. doi:10.4103/1673-5374.135330 [13] Wolfgang R, Balzer T, Grosu DS, Allkemper T. Clinical MR Imaging. Springer-Verlag Berlin Heidelberg. 2010. doi:10.1007/978-3-540-74504-4_2 [14] Meoded A, Poretti A, Benson JE, Tekes A, Huisman TA. Evaluation of the ischemic penumbra focusing on the venous drainage: the role of susceptibility weighted imaging (SWI) in pediatric ischemic cerebral stroke. J Neuroradiol. 2014;41(2):108-116. doi:10.1016/j.neurad.2013.04.002 [15] Bhattacharjee R, Gupta RK, Das B, Dixit VK, Gupta P, Singh A. Penumbra quantification from MR SWI-DWI mismatch and its comparison with MR ASL PWI-DWI mismatch in patients with acute ischemic stroke. NMR Biomed. 2021;34(7):e4526. doi:10.1002/nbm.4526 [16] Kesavadas C, Santhosh K, Thomas B. Susceptibility weighted imaging in cerebral hypoperfusion-can we predict increased oxygen extraction fraction?. Neuroradiology. 2010;52(11):1047-1054. doi:10.1007/s00234-010-0733-2 [17] Kao HW, Tsai FY, Hasso AN. Predicting stroke evolution: comparison of susceptibility-weighted MR imaging with MR perfusion. Eur Radiol. 2012;22(7):1397-1403. doi:10.1007/s00330-012-2387-4 [18] Sparacia G, Speciale C, Banco A, Bencivinni F, Midiri M. Accuracy of SWI sequences compared to T2*-weighted gradient echo sequences in the detection of cerebral cavernous malformations in the familial form. Neuroradiol J. 2016;29(5):326-335. doi:10.1177/1971400916665376 [19] Ruíz DS, Yilmaz H, Gailloud P. Cerebral developmental venous anomalies: current concepts. Ann Neurol. 2009;66(3):271-283. doi:10.1002/ana.21754 [20] Carocci A, Catalano A, Sinicropi MS, Genchi G. Oxidative stress and neurodegeneration: the involvement of iron. Biometals. 2018;31(5):715-735. doi:10.1007/s10534-018-0126-2 [21] Belaidi AA, Bush AI. Iron neurochemistry in Alzheimer's disease and Parkinson's disease: targets for therapeutics. J Neurochem. 2016;139 Suppl 1:179-197. doi:10.1111/jnc.13425 [22] Wang Z, Luo XG, Gao C. Utility of susceptibility-weighted imaging in Parkinson's disease and atypical Parkinsonian disorders. Transl Neurodegener. 2016;5:17. doi:10.1186/s40035-016-0064-2 [23] Blazejewska AI, Schwarz ST, Pitiot A, et al. Visualization of nigrosome 1 and its loss in PD: pathoanatomical correlation and in vivo 7 T MRI. Neurology. 2013;81(6):534-540. doi:10.1212/WNL.0b013e31829e6fd2 [24] Gao P, Zhou PY, Wang PQ, et al. Universality analysis of the existence of substantia nigra "swallow tail" appearance of non-Parkinson patients in 3T SWI. Eur Rev Med Pharmacol Sci. 2016;20(7):1307-1314. [25] Zorzenon CD, Bienes GH, Alves ED, Tibana LA, Júnior HC, Ferraz HB. Magnetic resonance imaging evaluation of nigrosome 1 and neuromelanin can assist Parkinson's disease diagnosis, but requires an expert neuroradiologist. Parkinsonism & Related Disorders. 2021;1;83:8-12. doi.org/10.1016/j.parkreldis.2020.12.006 [26] Zhao XJ, Niu XY, You HY, et al. Signal Alteration of Substantia Nigra on 3.0T Susceptibility-weighted Imaging in Parkinson's Disease and Vascular Parkinsonism. Curr Med Sci. 2019;39(5):831-835. doi:10.1007/s11596-019-2113-4 [27] Thanvi B, Lo N, Robinson T. Vascular parkinsonism--an important cause of parkinsonism in older people. Age Ageing. 2005;34(2):114-119. doi:10.1093/ageing/afi025 [28] McFarland NR. Diagnostic Approach to Atypical Parkinsonian Syndromes. Continuum (Minneap Minn). 2016;22(4 Movement Disorders):1117-1142. doi:10.1212/CON.0000000000000348 [29] Yoon RG, Kim SJ, Kim HS, et al. The utility of susceptibility-weighted imaging for differentiating Parkinsonism-predominant multiple system atrophy from Parkinson's disease: correlation with 18F-flurodeoxyglucose positron-emission tomography. Neurosci Lett. 2015;584:296-301. doi:10.1016/j.neulet.2014.10.046