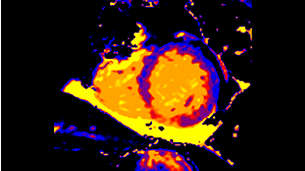
Современные методики картирования миокарда являются перспективными для диагностики диффузных изменений структуры миокарда. Рутинное применение Т1, Т2 и ECV открывает новые горизонты выявления и анализа наиболее трудных в диагностическом плане патологий сердца, а также может играть значительную роль в оценке прогноза заболеваний и ответа на терапию.
Обединская Наталья Ростиславовна,
врач-рентгенолог, заместитель заведующей отделения "МРТ технологии" Института "Международный томографический центр"
Магнитно-резонансная томография на сегодняшний день незаменима в диагностике широкого спектра заболеваний. Методики количественной МРТ, находящие применение во множестве клинических областей и вытесняющие инвазивные диагностические процедуры, занимают особое место в случае с заболеваниями сердечно-сосудистой системы. В отличие от классических методов МР-диагностики, основанных на том, что интенсивности сигналов нормальной и патологической ткани различаются, в кардио-МРТ патологические изменения в миокарде (фиброз, отложение амилоида) обладают низкой контрастностью относительно здоровой ткани. Данная особенность заболеваний сердечно-сосудистой системы существенно ограничивает чувствительность и диагностическую точность методов, основанных лишь на визуальной оценке и анализе крови при инфаркте миокарда. В связи с этим для выявления патологии миокарда применяются количественные параметры, позволяющие различить здоровую и патологическую ткань - времена релаксации T1, T2 и T2 и отклонение вектора намагниченности. Исследование этих количественных характеристик для разных типов тканей предполагает определение нормальных значений для здоровых добровольцев, причем статистическая достоверность растет по мере увеличения размера референсной группы. Отклонение любого из вышеперечисленных параметров от нормальных значений может свидетельствовать о патологии (например, инфаркт миокарда, острый миокардит и пр.).
Количественные методики T1- и T2-картирования способствуют более точной и объективной интерпретации результатов путем сравнения с референсными значениями.
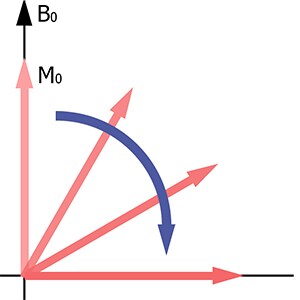
В клинической практике наиболее важно T1-картирование, проводимое как без, так и с контрастированием. В основе получения T1-карт лежит процесс T1-релаксации. В начале каждой импульсной последовательности используется радиочастотный (РЧ) импульс, который отклоняет вектор намагниченности от направления основного магнитного поля томографа B0. Это сопровождается резким спадом продольной (сонаправленной полю B0) намагниченности (рис.1).
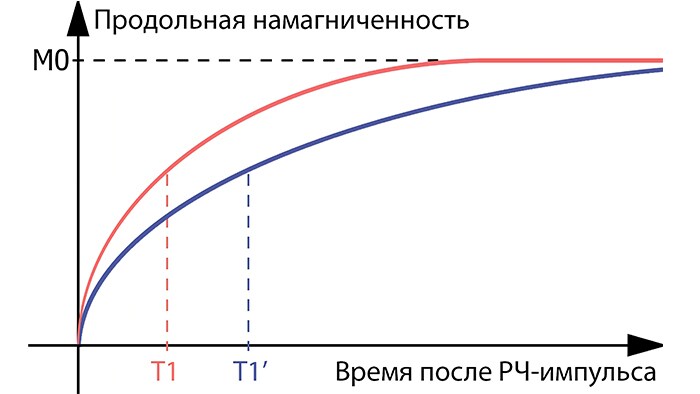
После выключения РЧ-импульса начинается T1-релаксация – возвращение вектора намагниченности в начальное состояние M0. При этом время T1, которое определяет скорость T1-релаксации, отличается между разными тканями (рис.2); так, в тканях с длинным T1 наблюдается медленное восстановление намагниченности. Для построения T1-карты миокарда в разные моменты времени после отклоняющего РЧ-импульса регистрируется несколько эхо-сигналов. Их интенсивность указывает на изменение значения продольной намагниченности со временем, что позволяет найти время T1-релаксации.
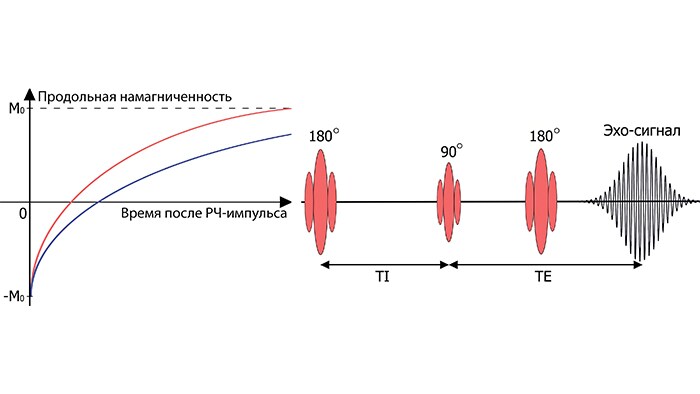
Для более точного определения параметра T1, как правило, используют 180-градусный РЧ-импульс, который изменяет значение продольной намагниченности с M0 до -M0. Как было сказано ранее, после прекращения действия этого импульса начинается процесс T1-релаксации (рис.3, слева). В простейшем случае необходимые для расчета T1 данные можно получить, проведя серию измерений интенсивности эхо-сигнала (рис.3, справа) в зависимости от времени инверсии TI (время между 180-градусным и возбуждающим РЧ-импульсами).
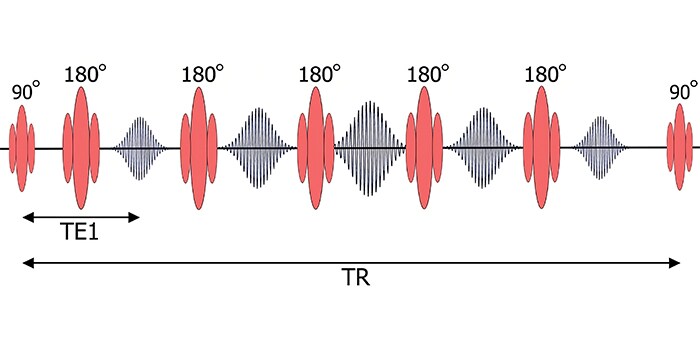
Модифицированная методика визуализации Лук-Локера (Modified Look-Locker Imaging, MOLLI) значительно сокращает время сканирования по сравнению с вышеописанным способом; схема MOLLI приведена на рис. 4. Один цикл этой последовательности содержит две фазы, начинающихся со 180-градусного отклоняющего РЧ-импульса и разделенных 3-х секундной паузой. За первую фазу регистрируются эхо-сигналы для 5 разных TI, за следующую – еще для 3. Все 8 значений интенсивности эхо, полученных за полный цикл MOLLI, используются для построения T1-карты.
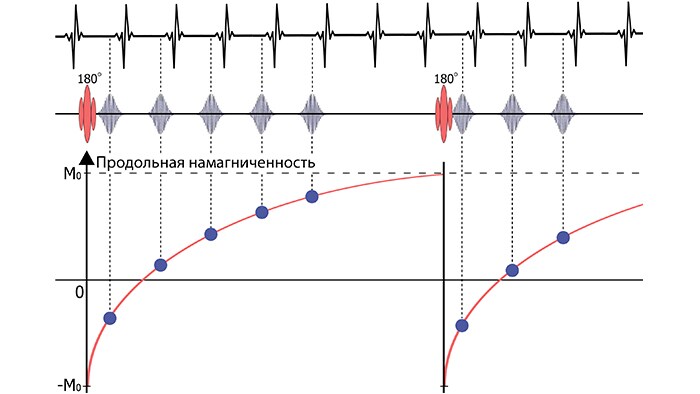
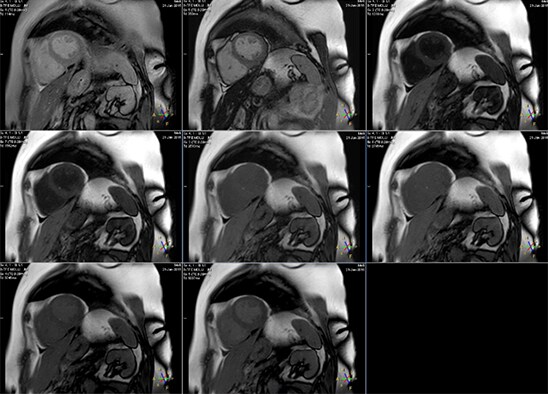
За счет синхронизации с ЭКГ регистрация каждого эхо-сигнала происходит в один и тот же момент фазы сердечного цикла. Пауза в 3 секунды между первыми 5 и последующими 3 точками сбора данных необходима для полного восстановления продольной намагниченности до своего начального значения, что повышает точность получаемых времен T1. Конечный результат последовательности MOLLI – 8 изображений, отвечающих разным TI (рис.5), а также T1-карта, яркость каждого пикселя которой отражает значение T1. Изображения отсортированы по времени TI.
Времена T1, получаемые с помощью MOLLI, подвержены влиянию времени T2-релаксации тканей, неоднородностей магнитного поля и эффекта переноса намагниченности, что приводит к систематическому занижению значений T1 [1]. Несмотря на это MOLLI нашла широкое применение благодаря высокому качеству T1-карт и хорошей воспроизводимости ее результатов. Были предложены и другие методики, не зависящие от вышеупомянутых факторов, такие как SASHA (SAturation recovery single-SHot Acquisition) и SAPPHIRE (SAturation Pulse Prepared Heart-Rate Independent Inversion REcovery). В случае с SASHA серию изображений с переменным временем насыщения (время между насыщающим РЧ-импульсом и моментом записи данных в центр k-пространства) получают с последовательностью градиентное эхо, за один цикл последовательности собираются все необходимые для построения изображения данные, причем, в отличие от MOLLI, конечная T1-карта не зависит от T2 и эффективности инверсии [2]. SAPPHIRE сочетает в себе принципы, используемые в последовательностях MOLLI и SASHA, и не подвержена влиянию: T2, эффекта переноса намагниченности, а также частоты сердечных сокращений, что важно в случае с пациентами с аритмией [3, 4]. Как SASHA, так и SAPPHIRE позволяют рассчитывать более достоверные, не зависящие от T2, но менее воспроизводимые значения T1.
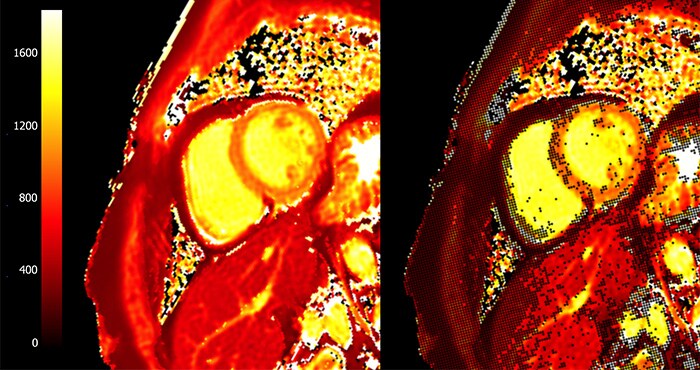
Изначально T1-картирование проводилось без контраста, что давало возможность неинвазивно установить факт наличия фиброза, но не оценить степень поражения миокарда. В настоящее время повсеместно используется T1-картирование с контрастированием (гадолиний). Количественная оценка осуществляется путем расчета фракции внеклеточного объема ECV. Разница времен T1 до (T10) и после (T1’) введения гадолиния зависит от его концентрации, что позволяет оценить содержание контрастного агента в крови и внеклеточном матриксе миокарда на основании времен T10 и T1’. При расчете ECV также учитывается значение гематокрита, так как гадолиний может распространяться лишь в объеме крови, не занятым ее форменными элементами:
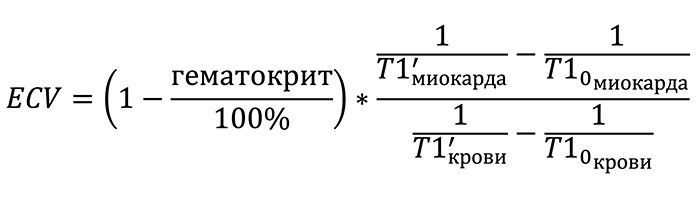
Важно отметить, что значение ECV не зависит от силы поля томографа (в отличие от параметра T1, который увеличивается по мере роста силы поля). На ECV также не влияет скорость выведения контрастного агента, которая индивидуальна для каждого пациента и ограничивает точность измерения T1’ [5].
Наиболее распространенные патологические изменения, характеризующиеся длинными временами T1 – отек, фиброз и отложение амилоида; отложения жира и железа соответствуют более коротким (относительно нормы) T1 [6]. Повышенные значения ECV говорят о высоком содержании гадолиния в миокарде, что соответствует увеличению объема внеклеточного матрикса и может указывать на амилоидоз, острый и хронический инфаркт миокарда. Анализ как ECV, так и времени релаксации T1 делает возможным дифференциальную диагностику ряда заболеваний сердечно-сосудистой системы. В частности, острый инфаркт отличается более высоким значением T1 по сравнению с хроническим.
Получение T2-карт: основы и импульсная последовательность
Процесс получения T2-карт во многом напоминает T1-картирование с той разницей, что в данном случае измеряется процесс T2-релаксации. После действия возбуждающего РЧ-импульса взаимодействие протонов между собой приводит к уменьшению поперечной намагниченности Mxy за характерное время T2 (в случае спин-эхо последовательности) или T2* (последовательность градиентное эхо). Определив значения Mxy в разные моменты времени после РЧ-импульса, можно рассчитать время релаксации T2/T2*. При этом, в отличие от T2, параметр T2* учитывает спад поперечной намагниченности Mxy, вызванный присутствием магнетиков (железо, кальций и пр.) в тканях, поэтому T2* всегда короче T2.
Для T2-картирования применяется последовательность турбо спин-эхо с несколькими эхо (Multi-echo Turbo Spin Echo, mTSE). Ее схема приведена на рис. 7, характерное число эхо – 6, время первого эхо – 4 мс, время повторения (TR) соответствует одному сердечному циклу. По интенсивности каждого зарегистрированного эхо-сигнала определяется время T2, что необходимо для построения T2-карты.
Для T2*-картирования используют последовательность быстрое полевое эхо с несколькими временами эхо (Multi-echo Fast Field Echo, mFFE), типичные параметры: число эхо - 15, время первого эхо – 1.1 мс, TR – 16 мс. Так как эхо сигнал формируется не 180-градусным РЧ-импульсом, а градиентом магнитного поля, неоднородности магнитного поля дают вклад в интенсивность эхо-сигнала, что позволяет найти T2*. Большое количество эхо в совокупности с ранним первым эхо обуславливают высокую точность определения как коротких, так и длинных времен T2*.
Клинические применения T1 и T2 картирования
Миокардит представляет собой воспалительную кардиомиопатию различной этиологии, включающей инфекционные, токсические и аутоимунные причины. Наиболее важными осложнениями миокардита являются сердечная недостаточность (вплоть до кардиогенного шока) и жизнеугрожающие аритмии.Заболевание обладает широким спектром клинических проявлений, причем многие симптомы неспецифичны [7]. Биопсия миокарда позволяет достоверно верифицировать миокардит, однако обладает рядом недостатков, связанных в первую очередь с инвазивностью процедуры, к тому же, отрицательный результат по данным биопсии не исключает наличие миокардита. В диагностике острого миокардита также прибегают к визуализации с подавлением сигнала от жира и воды (Short Tau Inversion Recovery, STIR). По STIR-изображениям рассчитывают отношение сигнала в миокарде к сигналу в одной из скелетных мышц. Неоднократно было показано [8, 9], что данное отношение повышено у пациентов с острым миокардитом. Методики картирования эффективны в качестве альтернативы STIR в силу более простой и надежной клинической интерпретации T1- и T2-карт, а также значительной зависимости сигнала STIR-изображений от параметров импульсной последовательности [10]. Согласно недавней обзорной статье Kotanidis et al. [11], посвященной методикам для диагностики острого миокардита, T2-картирование значительно превосходит как T2-взвешенные изображения в целом, так и вышеописанную методику отношения T2-сигнала по значению площади под кривой: 0.88 для T2-картирования против 0.78 для T2-взвешенных изображений (средние значения для нескольких исследований, приведенных в статье).
T1- и T2-картирование были включены в последние консенсусные рекомендации по диагностике острого миокардита (Lake Louise Criteria 2018, [12]). Согласно им, выделяют два основных и два дополнительных критерия для постановки данного диагноза. К основным критериям относят отек (повышение сигнала по данным Т2-картирования или на Т2-взвешенных изображениях) и повреждение миокарда (высокие значения T1/ECV или позднее контрастное усиление по данным LGE). К дополнительным относят наличие перикардита и систолическую дисфункцию левого желудочка.
В работе Luetkens et al. [13], использовавшей МР-томограф Ingenia 1.5 Тл, с участием 84 пациентов и здоровых добровольцев оценивалась эффективность различных МР-методик для диагностики острого миокардита. Лучше всего себя продемонстрировали T1- и T2-картирование; оптимальные пороговые значения T1 и T2, выше которых ставился диагноз острого миокардита составили 1000 и 56 мс соответственно (для силы поля 1.5 Тл). Li et al. [14] показали, что в случае с силой поля 3 Тл пороговые значения - 1228 и 58.5 мс.
Инфаркт миокарда определяется как некроз клеток сердца в результате продолжительной ишемии; данная патология является самой распространенной формой ишемической болезни сердца [15]. Одно из основных направлений терапии - восстановление кровоснабжения жизнеспособных областей, что улучшает клинический исход заболевания и обуславливает необходимость неинвазивной оценки функциональных показателей сердца и жизнеспособности миокарда [16]. В клинической практике на данный момент наиболее распространена методика отсроченного накопления контраста (Late Gadolinium Enhancement, LGE), основанная на более медленном выведении контраста из патологических тканей, в которых увеличен внеклеточный объем. В силу сокращения времени релаксации T1 в содержащих гадолиний тканях, они обладают высоким сигналом на LGE-изображениях, что может соответствовать зонам некроза, фиброза, отека или отложения амилоида. Субэндокардиальное или трансмуральное накопление контрастного препарата характерно для коронарогенного поражения миокарда. Жизнеспособность миокарда определяется совокупностью нескольких критериев, наиболее важным из которых является оценка глубины поражения миокарда по данным LGE-изображений. [17, 18]
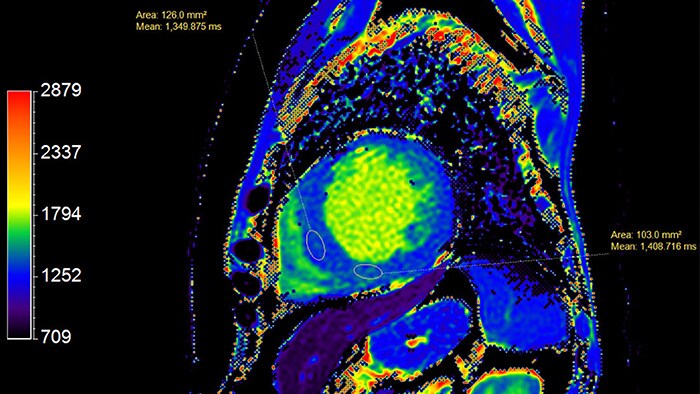
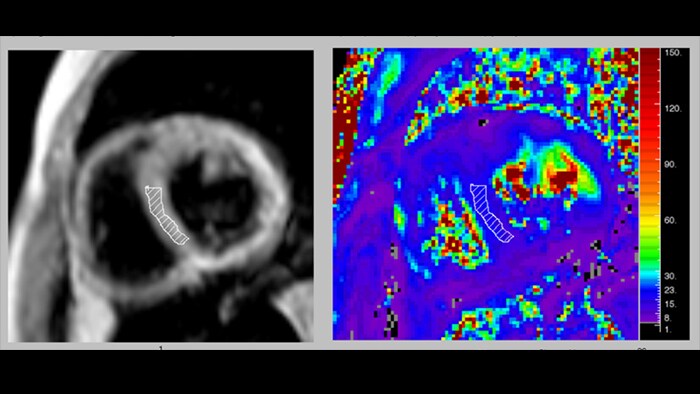
T1-картирование активно используется в диагностике инфаркта миокарда наряду с LGE. Известно, что ишемия приводит к развитию внутриклеточного отека, который, как было сказано ранее, вызывает рост времени T1 (для воды этот параметр может достигать вплоть до 5 с, в то время как типичное значение T1 в миокарде - 1-1.5 с). Инфаркт миокарда в хронической стадии (или постинфарктный кардиосклероз- ПИКС) сопровождается повышенным отложением коллагена в миокарде и образованием фиброзной рубцовой ткани, что характеризуется ростом T1.Таким образом, повышенные значения T1 (рис. 8) и ECV наблюдаются как при хронической, так и острой форме заболевания, и могут использоваться в качестве их биомаркеров. При этом рост значений более выражен при остром инфаркте миокарда, что позволяет дифференцировать данные заболевания.
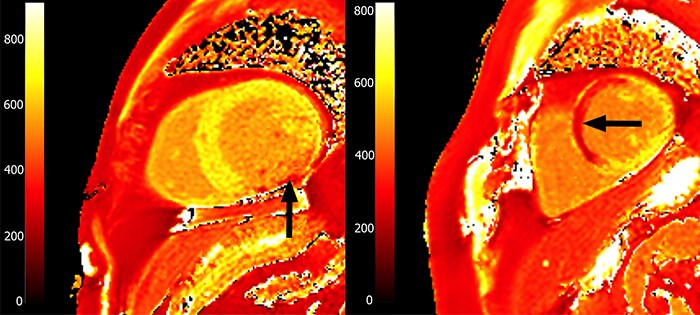
В случае T1-картирования с введением контраста, на получаемых картах зоны ПИКС выделяются на фоне здорового миокарда за счет повышенного накопления в них контрастного агента, который сокращает время T1. На рис. 9 видны области пониженного значения T1, соответствующие фиброзу в результате инфаркта. Слева - рубцовые изменения по нижней стенке левого желудочка, справа - рубцовые изменения в 7, 8 и частично 9 сегментах (согласно разработанной Американской кардиологической ассоциацией 17-сегментной модели сердца [19].
Т1-картирование является относительно новой методикой, которая еще не входит в рутинные протоколы сканирования. Тем не менее, на данный момент опубликовано множество клинических исследований, указывающих на превосходство T1-картирования в диагностике инфаркта миокарда по сравнению с другими методиками. Ниже кратко описаны результаты, полученные пользователями МР-томографов Philips.
Cameron et al. [20] сравнивали T1-картирование и T2-взвешенные изображения для выделения области отека миокарда у 62 пациентов, перенесших инфаркт с подъемом сегмента ST (ST-elevation myocardial infarction, STEMI). С помощью Achieva TX 3 Тл было показано, Что Т1-картирование позволяет дифференцировать зоны отека миокарда лучше, чем Т2-взвешенные изображения (площади под кривой 0.89 и 0.83 соответственно); пороговое значения для отека составило 1241 мс, что хорошо согласуется с полученным Liu et al. [21] значением в 1251 мс.
В работе Ma et al. [22] для диагностики острого инфаркта миокарда применялось T1-картирование в сочетании с текстурным анализом получаемых карт. В методике текстурного анализа оцениваются математические характеристики распределения интенсивности пикселей изображения (среднее, стандартное отклонение, асимметрия распределения и пр.), которые могут быть использованы для более объективной, количественной оценки характеристик изображения. Эффективность T1-картирования в сочетании с текстурным анализом была продемонстрирована, среди прочего, для оценки наличия микрососудистой обструкции (площадь под кривой 0.88) и дифференциации обратимых и необратимых повреждений сегментов миокарда (площадь под кривой 0.84) [22].
Исследование Garg et al. [23] показало, что параметр ECV позволяет определять области, находящиеся в риске инфаркта, а также объем инфаркта с большей точностью, чем T2-взвешенные изображения. В статье использовались МР-томографы Ingenia 1.5 Тл и Achieva TX 3 Тл, согласно результатам, области с ECV>33% являются регионами риска (периинфарктная зона), а значения ECV>46% указывают на инфаркт в этой области.
Нарушения обмена железа могут возникать в результате наследственных заболеваний, а также на фоне регулярных гемотрансфузий у пациентов с анемиями (вторичный гемохроматоз). Избыточное содержание железа в плазме крови приводит к насыщению транспортного белка трансферрина. Свободное, не связанное с трансферрином или ферритином железо быстро накапливается в тканях (в первую очередь в печени и сердце) и в силу высокой химической активности вызывает повреждение миокарда путем окислительного стресса.
Традиционно для мониторинга степени перегрузки железом используется T2*-картирование, чувствительное к отложениям железа, кальция и пр. Оценивается среднее значение параметра T2* или же анализируются значения в 16 различных сегментах миокарда согласно вышеупомянутой модели. Значения T2*<20 мс указывают на среднюю степень перегрузки, <10 мс - на сильную степень перегрузки железом, которая ассоциируется повышенным риском развития сердечной недостаточности [24]. В связи с этим T2*-картирование занимает важное место в клинической практике для своевременного начала хелаторной терапии.
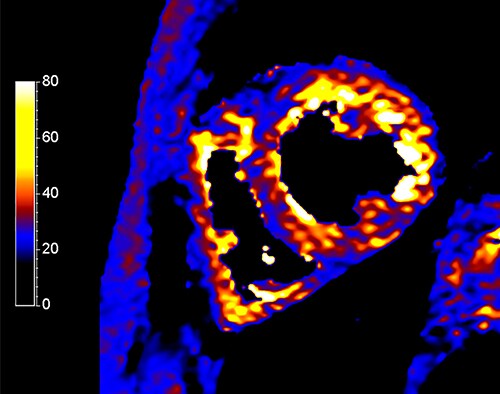
Несмотря на ограничения точности T1-картирования, обусловленные тем фактом, что низкий T1 может быть связан с болезнью Фабри, липамотозной метаплазией и пр. [1], параметр T1 также уменьшается в присутствии отложений железа. В работе Krittayaphong et al. [25] с помощью МР-томографа Philips Achieva 1.5 Тл и методики T1-картирования (MOLLI) измерялись значения T1 в сердце у 200 здоровых добровольцев и пациентов с талассемией. Оптимальное пороговое значение T1 для выявления перегрузки железом в сердце составило 887 мс, что соответствует чувствительности 100% и специфичности 98.4%. Это пороговое значение близко к полученному в статье Torlasco et al. (918 мс) [26], которая указывает на возможность использования как T2*-, так и T1-картирования для повышения чувствительности диагностической методики.
Амилоидоз - тяжелое прогрессирующее заболевание, сопровождающееся отложением белка-амилоида в различных тканях, в том числе в сердце. Биопсия миокарда находит ограниченное применение в силу большого числа ложно-отрицательных случаев и инвазивности процедуры [27]. Отложения амилоида вызывают резкий рост значений T1, что позволяет применять T1-картирования для ранней диагностики и последующего мониторинга эффективности терапии с высокой точностью (характерное значение площади под кривой - 0.95 [27]). Согласно обзорной статье Pan et al. [28], T1-картирование без введения контраста столь же эффективно как методики, использующие контрастирование, что крайне важно в силу распространенности почечной недостаточности у пациентов с амилоидозом.
В работе Korthals et al. [29], использовавшем МР-томограф Ingenia 1.5 Тл, оценивалась эффективность различных методик для дифференциации 30 пациентов с амилоидозом и 20 пациентов с гипертофической кардиомиопатией; согласно результатам, наиболее точные биомаркеры амилоидоза - повышенные значения T1 и ECV (усредненные по всему миокарду). В исследовании также принимали участие здоровые добровольцы, среднее значение T1 для них составило 983 мс против 1119 мс у пациентов с амилоидозом, что делает возможным дифференциацию этих групп.
В настоящий момент активно ведется разработка методик, позволяющих различать транстиретиновый (ATTR) и амилоидоз легких цепей (AL), так как терапия этих форм заболевания радикально отличаются (пересадка печени в случае ATTR, химиотерапия при AL) [30]. Методики картирования уже показали перспективные результаты - между параметрами T1 и ECV у пациентов с ATTR и пациентов с AL существуют статистически значимые различия [31].
Связанные продукты
-
CardiacQuant
С помощью приложения CardiacQuant можно получить доступ к важным приложениям для исследований сердца, которые могут облегчить неинвазивную оценку характеристик ткани миокарда, предоставляя пользователю подробные графики и количественные карты T2/R2, T2*/R2* и T1 на основе значений пикселов при сканировании с одной задержкой дыхания, способствуя принятию клинических решений на ранних этапах.
NMRB808
Связанные статьи
T2* картирование миокарда
Возможности методики QSM
Список использованной литературы:
[1] Aherne E, Chow K, Carr J. Cardiac T1 mapping: Techniques and applications. J Magn Reson Imaging. 2020;51(5):1336-1356. doi:10.1002/jmri.26866 [2] Chow K, Flewitt JA, Green JD, Pagano JJ, Friedrich MG, Thompson RB. Saturation recovery single-shot acquisition (SASHA) for myocardial T(1) mapping. Magn Reson Med. 2014;71(6):2082-2095. doi:10.1002/mrm.24878 [3] Weingärtner S, Akçakaya M, Basha T, et al. Combined saturation/inversion recovery sequences for improved evaluation of scar and diffuse fibrosis in patients with arrhythmia or heart rate variability. Magn Reson Med. 2014;71(3):1024-1034. doi:10.1002/mrm.24761 [4] Roujol S, Weingärtner S, Foppa M, et al. Accuracy, precision, and reproducibility of four T1 mapping sequences: a head-to-head comparison of MOLLI, ShMOLLI, SASHA, and SAPPHIRE. Radiology. 2014;272(3):683-689. doi:10.1148/radiol.14140296 [5] Jerosch-Herold M, Kwong RY. Cardiac T(1) imaging. Top Magn Reson Imaging. 2014;23(1):3-11. doi:10.1097/RMR.0000000000000013 [6] Haaf P, Garg P, Messroghli DR, Broadbent DA, Greenwood JP, Plein S. Cardiac T1 Mapping and Extracellular Volume (ECV) in clinical practice: a comprehensive review. J Cardiovasc Magn Reson. 2016;18(1):89. Published 2016 Nov 30. doi:10.1186/s12968-016-0308-4 [7] Lampejo T, Durkin SM, Bhatt N, Guttmann O. Acute myocarditis: aetiology, diagnosis and management. Clin Med (Lond). 2021;21(5):e505-e510. doi:10.7861/clinmed.2021-0121 [8] Luetkens JA, Doerner J, Thomas DK, et al. Acute myocarditis: multiparametric cardiac MR imaging. Radiology. 2014;273(2):383-392. doi:10.1148/radiol.14132540 [9] von Knobelsdorff-Brenkenhoff F, Schüler J, Dogangüzel S, et al. Detection and Monitoring of Acute Myocarditis Applying Quantitative Cardiovascular Magnetic Resonance. Circ Cardiovasc Imaging. 2017;10(2):e005242. doi:10.1161/CIRCIMAGING.116.005242 [10] Yilmaz A, Ferreira V, Klingel K, Kandolf R, Neubauer S, Sechtem U. Role of cardiovascular magnetic resonance imaging (CMR) in the diagnosis of acute and chronic myocarditis. Heart Fail Rev. 2013;18(6):747-760. doi:10.1007/s10741-012-9356-5 [11] Kotanidis CP, Bazmpani MA, Haidich AB, Karvounis C, Antoniades C, Karamitsos TD. Diagnostic Accuracy of Cardiovascular Magnetic Resonance in Acute Myocarditis: A Systematic Review and Meta-Analysis. JACC Cardiovasc Imaging. 2018;11(11):1583-1590. doi:10.1016/j.jcmg.2017.12.008 [12] Ferreira VM, Schulz-Menger J, Holmvang G, et al. Cardiovascular Magnetic Resonance in Nonischemic Myocardial Inflammation: Expert Recommendations. J Am Coll Cardiol. 2018;72(24):3158-3176. doi:10.1016/j.jacc.2018.09.072 [13] Luetkens JA, Homsi R, Sprinkart AM, et al. Incremental value of quantitative CMR including parametric mapping for the diagnosis of acute myocarditis. Eur Heart J Cardiovasc Imaging. 2016;17(2):154-161. doi:10.1093/ehjci/jev246 [14] Li S, Duan X, Feng G, et al. Multiparametric Cardiovascular Magnetic Resonance in Acute Myocarditis: Comparison of 2009 and 2018 Lake Louise Criteria With Endomyocardial Biopsy Confirmation. Front Cardiovasc Med. 2021;8:739892. Published 2021 Oct 12. doi:10.3389/fcvm.2021.739892 [15] Thygesen K, Alpert JS, Jaffe AS, et al. Third universal definition of myocardial infarction. J Am Coll Cardiol. 2012;60(16):1581-1598. doi:10.1016/j.jacc.2012.08.001 [16] Dastidar AG, Harries I, Pontecorboli G, et al. Native T1 mapping to detect extent of acute and chronic myocardial infarction: comparison with late gadolinium enhancement technique. Int J Cardiovasc Imaging. 2019;35(3):517-527. doi:10.1007/s10554-018-1467-1 [17] Garcia MJ, Kwong RY, Scherrer-Crosbie M, et al. State of the Art: Imaging for Myocardial Viability: A Scientific Statement From the American Heart Association. Circ Cardiovasc Imaging. 2020;13(7):e000053. doi:10.1161/HCI.0000000000000053 [18] Toupin S, Pezel T, Bustin A, Cochet H. Whole-Heart High-Resolution Late Gadolinium Enhancement: Techniques and Clinical Applications. J Magn Reson Imaging. 2022;55(4):967-987. doi:10.1002/jmri.27732 [19] Cerqueira MD, Weissman NJ, Dilsizian V, et al. Standardized myocardial segmentation and nomenclature for tomographic imaging of the heart. A statement for healthcare professionals from the Cardiac Imaging Committee of the Council on Clinical Cardiology of the American Heart Association. Circulation. 2002;105(4):539-542. doi:10.1161/hc0402.102975 [20] Cameron D, Siddiqi N, Neil CJ, et al. T₁ mapping for assessment of myocardial injury and microvascular obstruction at one week post myocardial infarction. Eur J Radiol. 2016;85(1):279-285. doi:10.1016/j.ejrad.2015.10.008 [21] Liu D, Borlotti A, Viliani D, et al. CMR Native T1 Mapping Allows Differentiation of Reversible Versus Irreversible Myocardial Damage in ST-Segment-Elevation Myocardial Infarction: An OxAMI Study (Oxford Acute Myocardial Infarction). Circ Cardiovasc Imaging. 2017;10(8):e005986. doi:10.1161/CIRCIMAGING.116.005986 [22] Ma Q, Ma Y, Yu T, Sun Z, Hou Y. Radiomics of Non-Contrast-Enhanced T1 Mapping: Diagnostic and Predictive Performance for Myocardial Injury in Acute ST-Segment-Elevation Myocardial Infarction. Korean J Radiol. 2021;22(4):535-546. doi:10.3348/kjr.2019.0969 [23] Garg P, Broadbent DA, Swoboda PP, et al. Acute Infarct Extracellular Volume Mapping to Quantify Myocardial Area at Risk and Chronic Infarct Size on Cardiovascular Magnetic Resonance Imaging. Circ Cardiovasc Imaging. 2017;10(7):e006182. doi:10.1161/CIRCIMAGING.117.006182 [24] Triadyaksa P, Oudkerk M, Sijens PE. Cardiac T2 * mapping: Techniques and clinical applications. J Magn Reson Imaging. 2020;52(5):1340-1351. doi:10.1002/jmri.27023 [25] Krittayaphong R, Zhang S, Saiviroonporn P, et al. Detection of cardiac iron overload with native magnetic resonance T1 and T2 mapping in patients with thalassemia. Int J Cardiol. 2017;248:421-426. doi:10.1016/j.ijcard.2017.06.100 [26] Torlasco C, Cassinerio E, Roghi A, et al. Role of T1 mapping as a complementary tool to T2* for non-invasive cardiac iron overload assessment. PLoS One. 2018;13(2):e0192890. Published 2018 Feb 21. doi:10.1371/journal.pone.0192890Kittleson MM, Maurer MS, Ambardekar AV, et al. Cardiac Amyloidosis: Evolving Diagnosis and Management: A Scientific Statement From the American Heart Association. Circulation. 2020;142(1):e7-e22. doi:10.1161/CIR.0000000000000792 [27] Wang TKM, Brizneda MV, Kwon DH, et al. Reference Ranges, Diagnostic and Prognostic Utility of Native T1 Mapping and Extracellular Volume for Cardiac Amyloidosis: A Meta-Analysis. J Magn Reson Imaging. 2021;53(5):1458-1468. doi:10.1002/jmri.27459 [28] Pan JA, Kerwin MJ, Salerno M. Native T1 Mapping, Extracellular Volume Mapping, and Late Gadolinium Enhancement in Cardiac Amyloidosis: A Meta-Analysis. JACC Cardiovasc Imaging. 2020;13(6):1299-1310. doi:10.1016/j.jcmg.2020.03.010 [29] Korthals D, Chatzantonis G, Bietenbeck M, Meier C, Stalling P, Yilmaz A. CMR-based T1-mapping offers superior diagnostic value compared to longitudinal strain-based assessment of relative apical sparing in cardiac amyloidosis. Sci Rep. 2021;11(1):15521. Published 2021 Jul 30. doi:10.1038/s41598-021-94650-2 [30] Hazenberg BP. Amyloidosis: a clinical overview. Rheum Dis Clin North Am. 2013;39(2):323-345. doi:10.1016/j.rdc.2013.02.012[31] Fontana M, Banypersad SM, Treibel TA, et al. AL and ATTR cardiac amyloid are different: native T1 mapping and ECV detect different biology. J Cardiovasc Magn Reson. 2014;16(1):1-2. doi:10.1186/1532-429X-16-S1-P341