Время чтения: 4–5 минут
ЧКВ с ультранизкой дозой контрастного вещества
ОПП является серьезным осложнением ЧКВ
Большинство пациентов с заболеваниями сердца относятся к группе высокого риска развития острого поражения почек (ОПП). Сердечная недостаточность, инфаркт миокарда с подъемом сегмента ST (STEMI), кардиогенный шок, хроническая болезнь почек (ХБП), возраст > 75 лет и сахарный диабет способствуют более высокой частоте развития контраст-индуцированной нефропатии (КИН).1

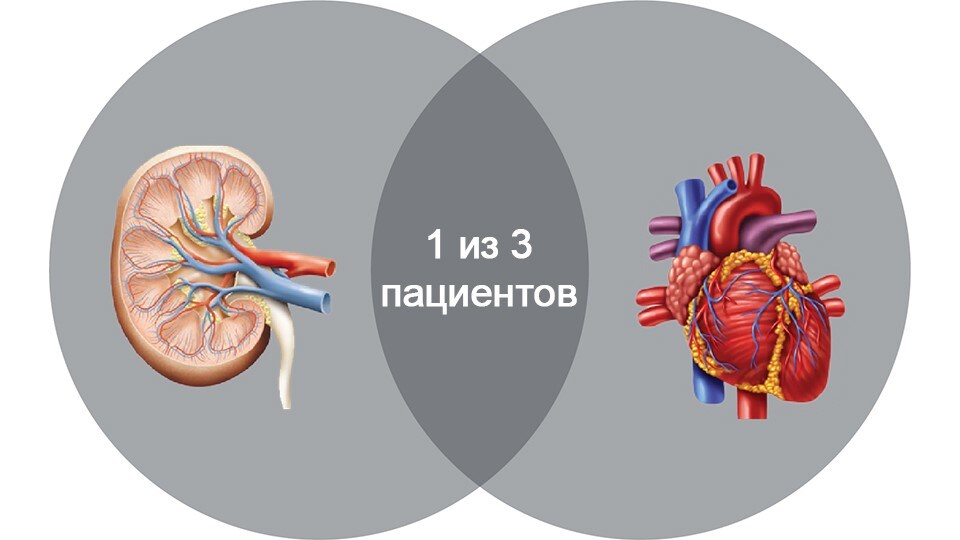
ОПП поражает 1 из 5 госпитализированных пациентов2
Смертность в стационаре у пациентов с ОПП составляет 20–25 %; при этом этот показатель равен 50 % у пациентов, находящихся на диализе3
Узнайте о клинических техниках снижения объема применяемого контрастного вещества

Коронарография с ультранизкой дозой контрастного вещества и ЧКВ с нулевым контрастированием для профилактики контраст-индуцированной нефропатии: пошаговый алгоритм и обзор методики
Проф. Дариуш Дудек
Президент Европейской ассоциации ЧКВ, Европейского сообщества кардиологов
Ягеллонский университет
Краков, Польша
Узнайте больше о клинических случаях ЧКВ с ультранизкой дозой контрастного вещества вместе с врачами со всего мира
Посмотрите Симпозиум по ЧКВ с ультранизкой дозой контрастного вещества на EuroPCR 2020
Посмотрите симпозиум по ЧКВ с ультранизкой дозой контрастного вещества на EuroPCR 2021
Узнайте больше, посмотрев видео, на котором проф. Эсканед обсуждает вопрос снижения контрастного вещества с помощью приложения Dynamic Coronary Roadmap
Д-р Аль Азизи объясняет, почему для него важно снижение дозы контрастного вещества при ЧКВ
Д-р Каки делится советами по применению эффективных инструментов и техник для ЧКВ с ультранизкой дозой контрастного вещества
Подход к использованию контрастного вещества при ЧКВ
Принцип ALARA (as low as reasonably achievable) – широко используемый подход к использованию контрастного вещества при ЧКВ, который говорит о минимизации дозы до максимально приемлемого уровня с целью снижения риска потенциального развития контраст-индуцированного острого поражения почек (КИ-ОПП).
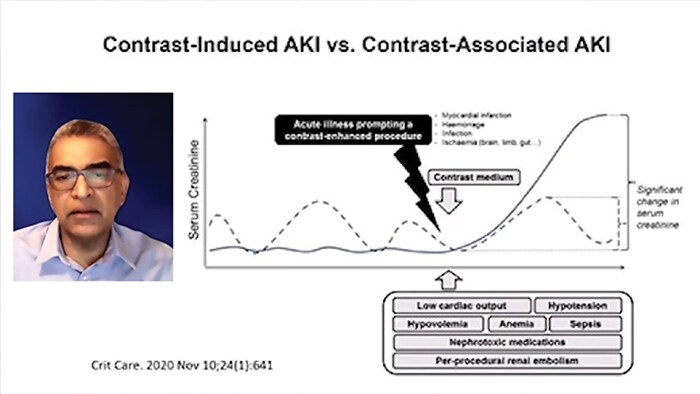
Рентгеноконтрастное вещество имеет «двойную» модель прямой контраст-индуцированной токсичности эпителиальных клеток почечных канальцев и вазоконстрикции в почечных артериях, которые могут продолжаться до нескольких часов, что приводит к ишемии почек и снижению скорости клубочковой фильтрации (СКФ), обуславливая тем самым повышение уровня креатинина. Это осложнение увеличивает продолжительность пребывания пациента в стационаре и больничные расходы.
КИ-ОПП (так называемая контраст-индуцированная нефропатия, КИН) является одним из основных причин внутрибольничного ОПП:
Новые методы инвазивной визуализации и программное обеспечение для ко-регистрации позволяют выполнять ЧКВ с ограниченным объемом контрастного средства и даже проводить ЧКВ с нулевым контрастированием для снижения риска развития КИ-ОПП для всех пациентов, особенно для пациентов с почечной недостаточностью.
5,73% пациентов покидают операционную с ОПП после ЧКВ5. У пациентов с ОПП затраты на госпитализацию были выше, чем у пациентов без ОПП ($38 869, SD 42 583 по сравнению с $17 167 SD 13 994, p < 0,001).

ОПП было связано с увеличением стоимости госпитализации на 9448 долл. США5
ОПП было связано с увеличением продолжительности пребывания в стационаре на 3,6 дня5
Каждые дополнительные 75 мл контрастного вещества увеличивали риск развития ОПП на 42 %15
Регистр CathPCI Национального реестра данных по сердечно-сосудистым заболеваниям (NCDR, National Cardiovascular Data Registry) Американской коллегии кардиологов имеет низкий порог (повышение уровня креатинина в сыворотке крови на 0,3 мг/дл) для диагностирования ОПП и всячески поддерживает улучшение качества.
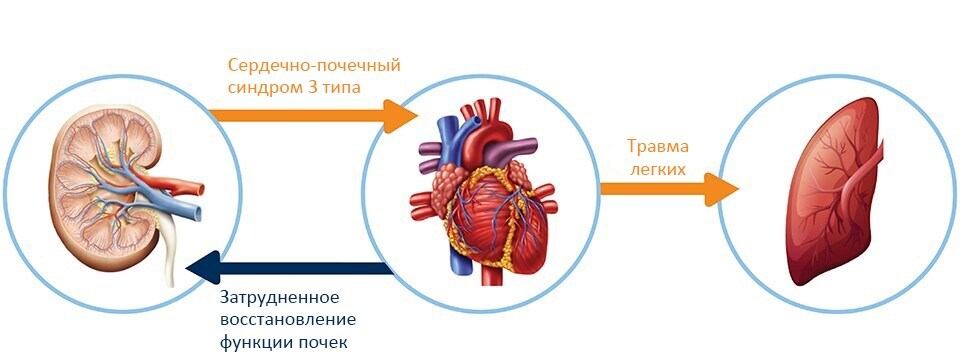
Последствия ОПП для сердца и лёгких
Было показано, что ОПП обуславливает поражение и дисфункцию миокарда, определяемое как кардиоренальный синдром 3 типа. Сердечная недостаточность, в свою очередь, может препятствовать восстановлению функции почек. Повреждение легких и гипоксемия после острого поражения почек могут возникать как из-за повышенной проницаемости капилляров, так и ввиду повышенного гидростатического давления в капиллярах вследствие сердечной недостаточности.6
Высокий риск развития ИБС
Сердечно-сосудистые заболевания являются основной причиной смерти среди пациентов с хронической болезнью почек (ХБП), стадий IV-V и последний стадии заболевания почек, при этом уровень скорости клубочковой фильтрации (СКФ) является независимым прогностическим фактором атеросклеротического сердечно-сосудистого заболевания7.
Уровень вероятности сердечно-сосудистого риска в зависимости от стадии ХБП8*
| Стадия | Расчетная СКФ | Сердечно-сосудистый риск |
| 1 | >90† | Зависит от степени протеинурии |
| 2 | 30–89† | 1,5 |
| 3 | 30–59 | 2-4 |
| 4 | 15–29 | 4-10 |
| 5 | <15 | 10-50 |
| ТХПН | Диализ | 20-1000 |
∗ Увеличение риска по сравнению с пациентами, не имеющими ХБП, зависит от возраста исследуемой популяции: чем моложе пациент, тем выше относительный риск. Микроальбуминурия дополнительно увеличивает риск сердечно-сосудистых заболеваний в 2–4 раза.
† Признаки функциональных или структурных нарушений со стороны почек в течение ≥ 3 месяцев, определяемые как отклонения от нормы результатов биопсии почек, маркеры поражения почек (стойкая протеинурия, альбуминурия, гематурия) или структурные нарушения со стороны почек по данным визуализирующих исследований.
Пациенты с ХБП часто исключаются из РКИ, что приводит к отсутствию данных и делает лечение сердечно-сосудистых заболеваний в этой популяции очень сложным.
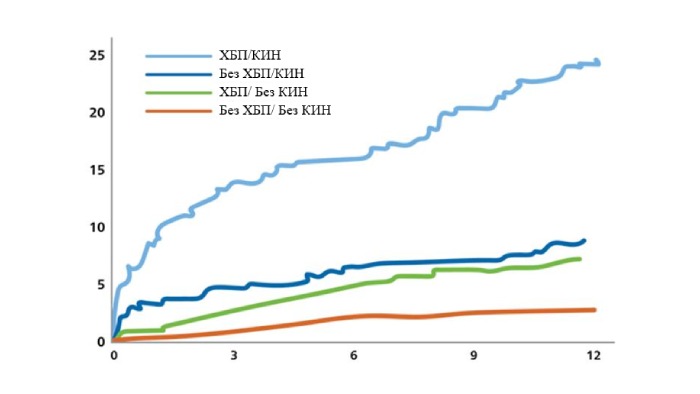
Смертность значительно возрастает через 1 год при наличии в анамнезе ХБП и КИН10
Влияние на почки11: У многих пациентов с ХБП ЧКВ будет отложено ввиду опасений по поводу КИН
Несмотря на потенциальную пользу при коронарной реваскуляризации у пациентов с ХБП в отношении показателей смертности, имеющих в анамнезе ОКС, диагностические и терапевтические коронарные вмешательства недостаточно используются у таких пациентов с ХБП, в том числе и у пациентов с ИМ с подъемом сегмента ST.
| Авторы12 | Клиническая картина | Пациенты (N) | ХБП | ХБП c инвазивным вмешательством | ХБП без инвазивного вмешательства |
| Чертоу и соавт. | ИМ | 57 284 | 26% | 25% | 47% |
| Хан и соавт. | ОКС без подъема сегмента ST | 45 343 | 14% | 48% | 74% |
| Голденберг и соавт. | ОКС без подъема сегмента ST | 13 141 | 32% | 50% | 68% |
| Шуммер и соавт. | ИМ | 57 477 | 33% | 33% | 58%a |
| Наута и соавт. | ИМ | 12 087 | 25%b | НЗ | НЗ |
ИМ — инфаркт миокарда; ОКС — острый коронарный синдром. ХБП, определяемая на основании рСКФ < 60 мл/мин на 1,73 м2
a Обозначает процент пациентов с инфарктом миокарда с подъемом сегмента ST, перенесших реваскуляризацию на основании статуса ХБП, определяемого как рСКФ < 60 мл/мин на 1,73 м2.
b ХБП, определяемая на основании рСКФ < 60 мл/мин на 1,73 м2.
Профилактика КИ-ОПП
Существует консенсус в отношении благоприятного эффекта гидратации в предотвращении КИ-ОПП. Гидратация увеличивает скорость потока мочи, снижает концентрацию контрастного вещества в канальцах и ускоряет выведение контрастного вещества, тем самым сокращая время, в течение которого клетки канальцев подвергаются токсическому воздействию13. Гидратацией пациента можно управлять с помощью протокола исследования Poseidon. Инфузионная терапия проводится под контролем конечного диастолического давления в левом желудочке (КДД ЛЖ). КДД ЛЖ является важным показателем работы желудочков и может выявлять пациентов с повышенным риском развития поздних клинических симптомов сердечной недостаточности (СН).
Болюс 3 мл/кг
КДД ЛЖ управляемая частота Х 4 часа
| КДД ЛЖ | Показатель |
| <13 | 5.0 мл/кг/ч |
| 13-18 | 3.0 мл/кг/ч |
| >18 | 1.5 мл/кг/ч |
Объем контрастного вещества
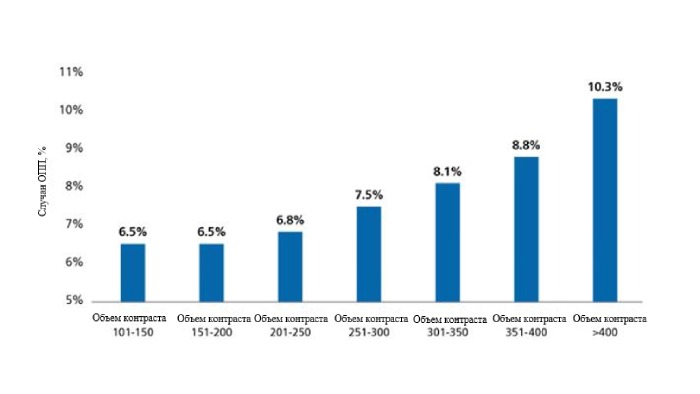
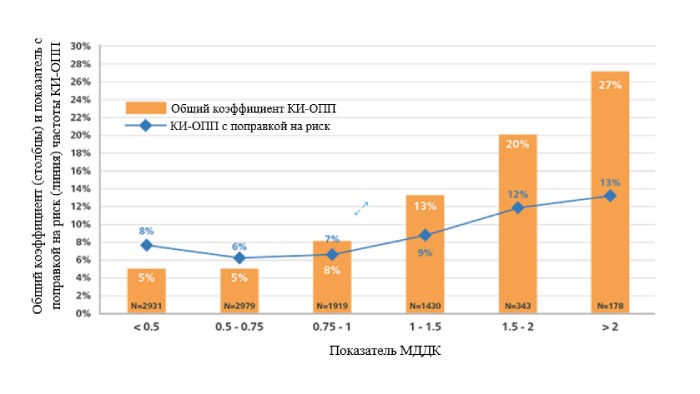
Объем контрастного вещества является ключевым фактором развития КИ-ОПП и играет наиболее важную роль для пациентов с высоким риском. Дополнительное использование контрастного вещества свыше максимально допустимой дозы контраста (МДДК) связано с повышенным риском развития КИ-ОПП.14
МДДК = соотношение объема контрастного вещества/рСКФ ≤ 1.
Показатель МДДК и КИ-ОПП. Расчётные соотношения объёма контрастного вещества к прогнозируемой МДДК представлены на графике с использованием общих коэффициентов (оранжевые столбцы) и показателей с поправкой на риск (синие ромбы) частоты КИ-ОПП.
Будьте в курсе предстоящих вебинаров, тренингов и новостей медицины
Технологии, поддерживающие снижение дозы контрастного вещества
Решения Philips для ЧКВ объединяют неинвазивные методы, а также ВСУЗИ и iFR, требующие меньше контраста для постановки правильного диагноза.




Ссылки
1. Mehran R, Aymong ED, Nikolsky E, et al. A simple risk score for prediction of contrast induced nephropathy after percutaneous coronary intervention: development and initial validation. J Am Coll Cardiol. 2004; 44(7): 1393-1399. doi:10.1016/j.jacc.2004.06.068. 2. Wang, H. E., Muntner, P., Chertow, G. M., & Warnock, D. G. (2012). Acute kidney injury and mortality in hospitalized patients. American Journal of Nephrology, 35(4), 349–355. https://doi.org/10.1159/000337487. 3. Brown, J. R., Rezaee, M. E., Nichols, E. L., Marshall, E. J., Siew, E. D., & Matheny, M. E. (2016). Incidence and In-Hospital Mortality of Acute Kidney Injury (AKI) and Dialysis-Requiring AKI (AKI-D) After Cardiac Catheterization in the National Inpatient Sample. Journal of the American Heart Association, 5(3), e002739. https://doi.org/10.1161/JAHA.115.002739. 4. Mohammed, N. M., Mahfouz, A., Achkar, K., Rafie, I. M., & Hajar, R. (2013). Contrast-induced Nephropathy. Heart views: the official journal of the Gulf Heart Association, 14(3), 106–116. doi:10.4103/1995-705X.125926. 5. Amin P, et al. Incremental cost of Acute Kidney Injury after Percutaneous Coronary Intervention in the United States. The American Journal of Cardiology, 125(1), 29–33. https://doi.org/10.1016/j.amjcard.2019.09.042. 6. Legrand, M. & Rossignol, P. 2020. Review article: Cardiovascular Consequences of Acute Kidney Injury. N Engl J Med 2020;382:2238-47. DOI: 10.1056/NEJMra1916393. 7. Manjunath G, et al. Level of Kidney Function as a Risk Factor for Atherosclerotic Cardiovascular Outcomes in the CommunityJACC 2003; 41:47–55. 8. Edwards, N. et al. Defining the Natural History of Uremic Cardiomyopathy in Chronic Kidney Disease: The Role of Cardiovascular Magnetic Resonance. J Am Coll Cardiol Img. 2014 Jul, 7 (7) 703–714. 9. Coca SG, Krumholz HM, Garg AX, Parikh CR. Underrepresentation of renal disease in randomized controlled trials of cardiovascular disease. JAMA. 2006; 296(11):1377-1384. 10. Dangas G, et al. Contrast-Induced nephropathy after percutaneous coronary interventions in relation to chronic kidney disease and hemodynamic variables. AJC 2005. 11. Chertow et al. “Renalism”: Inappropriately Low Rates of Coronary Angiography in Elderly Individuals with Renal Insufficiency. J Am Soc Nephrol 15: 2462-2468, 2004. 12. Weisbord S. AKI and Medical Care after Coronary Angiography: Renalism Revisited. CJASN November 2014, 9 (11) 1823-1825; DOI: https://doi.org/10.2215/CJN.09430914. 13. Brar et al. Hemodynamic-guided fluid administration for the prevention of contrast-induced acute kidney injury: the POSEIDON randomized controlled trial. Lancet 2014. DOI: https://doi.org/10.1016/S0140-6736(14)60689-9. 14. Brown et al. Does Safe Dosing of Iodinated Contrast Prevent Contrast-Induced Acute Kidney Injury? Circ Interv 2010;3:346-350. 15. Amin, A. P., Bach, R. G., Caruso, M. L., Kennedy, K. F., and Spertus, J. A. (2017). Association of Variation in Contrast Volume With Acute Kidney Injury in Patients Undergoing Percutaneous Coronary Intervention. JAMA cardiology, 2(9), 1007–1012. https://doi.org/10.1001/jamacardio.2017.2156.