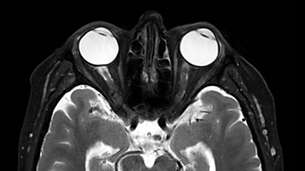
В последние годы стало ясно, что жировые клетки очень физиологически активны, а также принимают непосредственное участие в осуществлении эндокринных, метаболических, гематологических и иммунных функций. Неинвазивная количественная оценка эктопического жирового состава является важной диагностической задачей.
Жировые клетки традиционно рассматривались как простое пассивное хранилище энергии. Однако в последние годы стало ясно, что жировые клетки очень физиологически активны, а также принимают непосредственное участие в осуществлении эндокринных, метаболических, гематологических и иммунных функций. К примеру, такие клетки секретируют широкий спектр гормонов, ферментов и матричных белков, которые взаимодействуют с различными системами организма, включая гипоталамо-гипофизарную ось, поджелудочную железу, печень, почки, эндотелий, скелетные мышцы, иммунную систему и др. Наибольшее число жировых клеток содержится в подкожной жировой ткани и висцеральной, окружающей различные органы, такие как печень, почки, сердце и др. Помимо этого, жировые клетки могут накапливаться внутри органов и тканей (печень, сердце, костный мозг и др.) в виде эктопических жировых отложений. В ряде случаев отклонение в эктопическом жировом составе может свидетельствовать о нарушениях вследствие различных патологий: метаболический синдром, заболевания кроветворной системы, диабет, онкологические заболевания и множество других. Таким образом, неинвазивная количественная оценка эктопического жирового состава является важной диагностической задачей. Наилучшим образом для такой оценки подходят методики магнитно-резонансной томографии, так как большую часть МР сигнала формируют молекулы водорода, входящие в состав жира и воды. Существует несколько подходов к получению количественной информации о водно-жировом составе исследуемой ткани. Все они в итоге сводятся к разделению сигналов, идущих от протонов, входящих в состав воды и жира. Относительное содержание жира (FF, англ. fat fraction) в таком случае рассчитывается из интегральных интенсивностей сигналов воды (SH20) и жира (SFat) с помощью простой формулы:
(1)
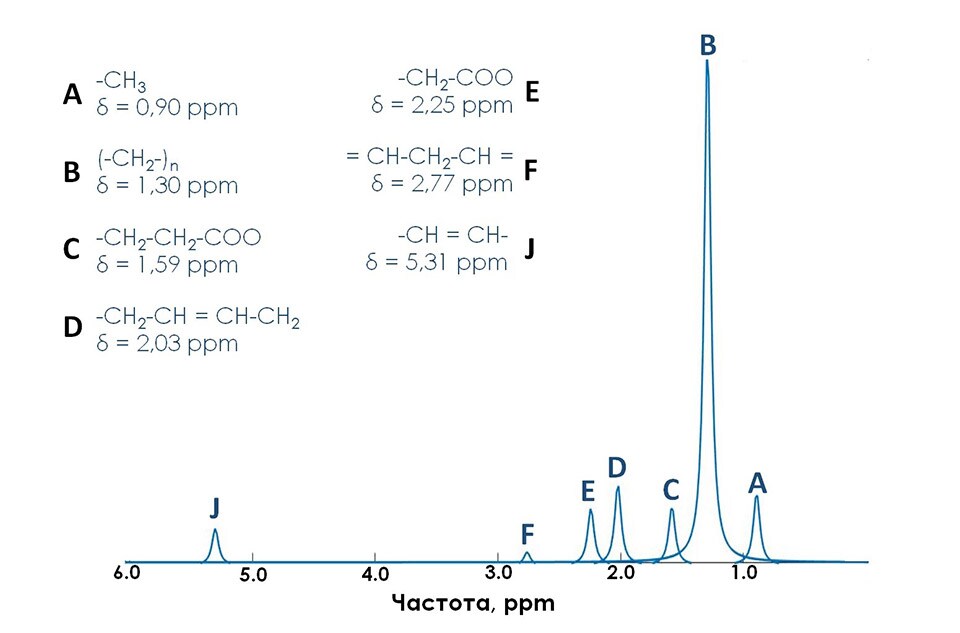
Параметр FF может быть использован как количественный неинвазивный биомаркер различных биологических и патологических процессов. В основе методик расчета значений FF лежит физическое явление химического сдвига (англ. chemical shift), при котором происходят малые отклонения от несущей резонансной частоты. Эти отклонения напрямую зависят от того, в состав каких структурных фрагментов молекул входят резонирующие ядра водорода. Для обозначения химического сдвига вводят безразмерную величину , за единицу которой принимается одна миллионная доля напряженности поля или резонансной частоты (ppm). Более подробно о природе явления химического сдвига будет рассказано в одном из следующих дайджестов. Так, к примеру, протоны, входящие в разнородные функциональные группы молекулы жира, имеют различные значения химических сдвигов [1], в свою очередь, отличные от химического сдвига воды. Наилучшим образом визуализировать отличия химических сдвигов получается с помощью МР спектроскопии, являющейся на данный момент “золотым стандартом” измерения соотношения жир/вода [2] в научно-клинических исследованиях. На рисунке 1 представлен теоретический спектр молекул жира и воды с указанием всех сигналов от основных функциональных групп жира и воды.
Альтернативным методом, позволяющим получать карты распределения жира являются методы МРТ, кодированной по химическому сдвигу (англ. chemical shift-encoded MRI (CSE MRI)) [2].
МР-спектроскопия
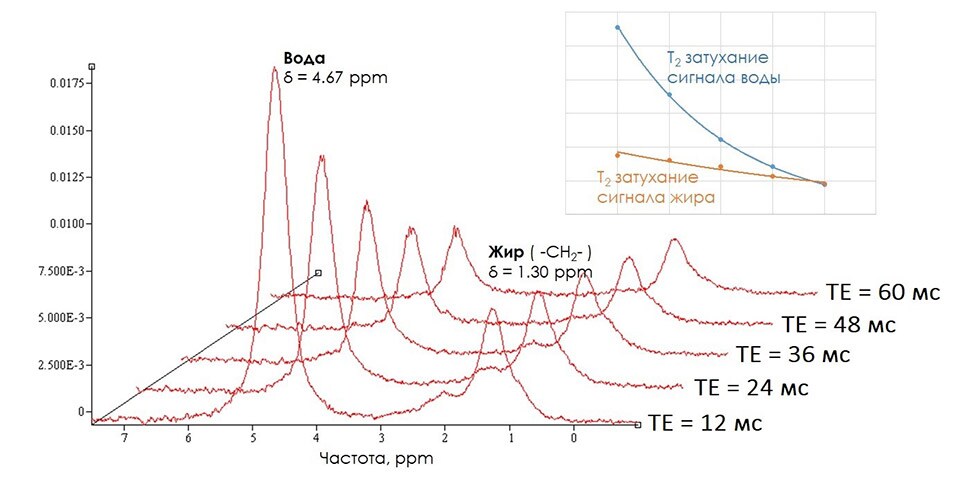
Наличие химического сдвига между резонансами воды и жира приводит к разделению этих сигналов в МР спектре, получаемом после Фурье-преобразования регистрируемого сигнала. Для расчета значений фракции жира используется стандартная последовательность STEAM. (Подробнее о методиках получения спектров можно ознакомиться в [3], а также в одном из следующих научных обзоров, публикуемых на сайте). Выбор последовательности STEAM определяется возможностью регистрировать спектры с минимальными временами ТЕ (≈12 мс). Так как значения Т2 релаксации сигналов воды и жира сильно отличаются друг от друга, регистрация спектров с ТЕ, отличными от нуля, вносит существенные ошибки в определения значений фракции жира. Коррекция вычисляемых интенсивностей воды и жира на Т2 релаксацию доступна при регистрации МР спектра с несколькими значениями TE. Чаще всего используется следующий набор значений ТЕ – 12-24-36-48-60 мс. Из получаемых спектров рассчитываются интегральные интенсивности сигналов воды (δ = 4.67 ppm) и жира (δ = 1.30 ppm). По ним с помощью методов экстраполяции (рис. 2.) рассчитываются значения интенсивностей сигналов при ТЕ = 0, то есть скорректированные значения. Для регистрации спектров без Т1 взвешенности требуется чтобы система полностью “отрелаксировала”. Это достигается при использовании времени повторения (TR), более или равном 5000 мс. Отсутствие Т2 и Т1 взвешенности позволяет получить значения фракции жира, взвешенной по протонной плотности (PDFF, англ. Proton density fat fraction) [4], используя формулу 1. Именно значения PDFF с высокой точностью соответствуют массовому и объемному содержанию жира [5].
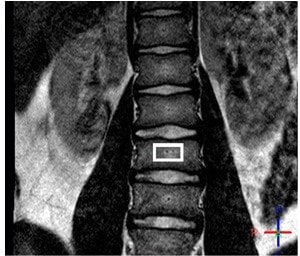
Примерные локализации 1Н МР спектров приведены на рисунке (3). МР спектроскопия, помимо расчета значений PDFF, позволяет определять параметры состава жирных кислот. Однако МР-спектроскопия не может быть использована для создания карт распределения жира внутри исследуемого органа, как это могут делать методы CSE MRI, что несомненно делает эти методики более привлекательными для медицинских приложений, учитывая тот факт, что распределение жира может быть неоднородно.
МРТ, кодированная по химическому сдвигу (CSE MRI). Dixon.
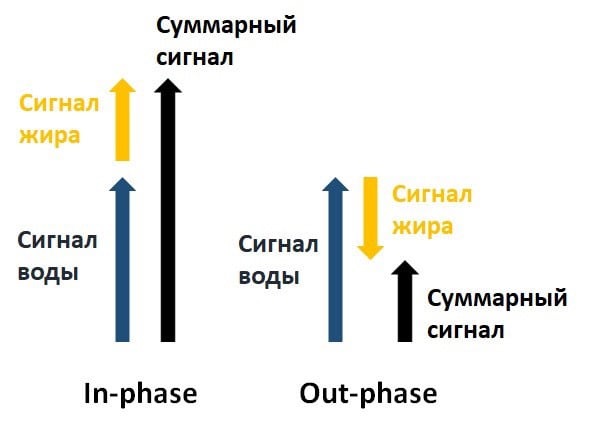
Одной из самых успешных и известных CSE MRI последовательностей является методика Dixon, первоначально изобретенная профессором Томасом Диксоном в 1984 году [6]. Разница между резонансными частотами сигналов воды и жира создает фазовый сдвиг между регистрируемыми сигналами этих двух компонент, который, в общем случае, является гармонической функцией времени эха (ТЕ). Времена ТЕ можно подобрать таким образом, чтобы сигналы воды были в одной фазе (англ. in-phase) или, наоборот, в противофазе (англ. out-phase) (рис. 4). Методика Dixon подразумевает под собой регистрацию in-phase и out-phase изображений. В случае, когда сигналы воды и жира находятся в одной фазе (in-phase), их суммарная интенсивность (S) в каждом отдельном пикселе изображения эквивалентна сумме сигналов воды (Water) и жира (Fat). В out-phase, наоборот, суммарная интенсивность показывает разницу этих сигналов (формула 1).
(2)
В результате, теоретически, можно получить изображения, отображающие только сигналы от воды и жира по формулам (3), и, как следствие, построить карту фракции жира, вычисляя в каждом пикселе относительное содержание жира по формуле (1).
(3)
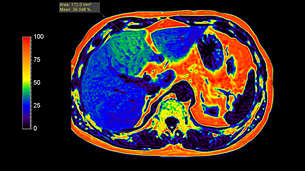
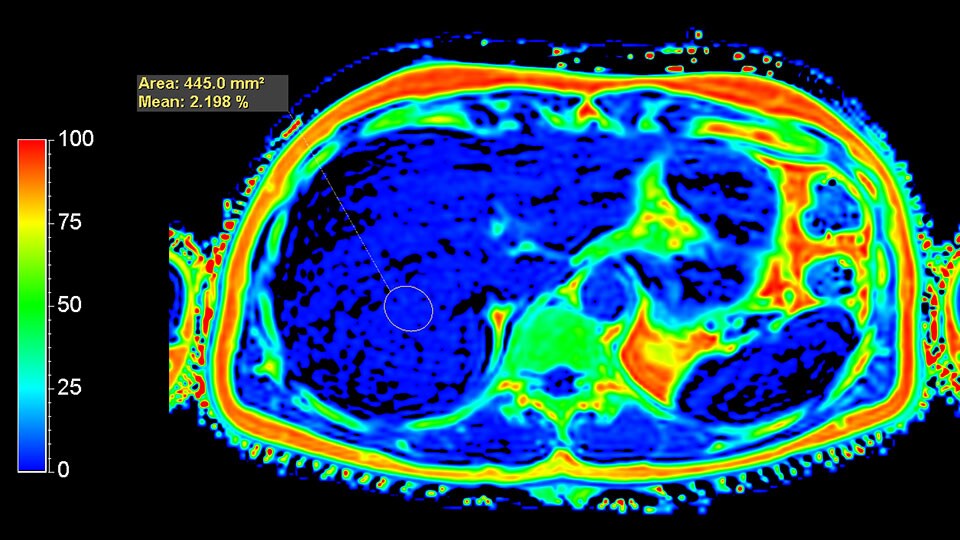
В литературе методика Dixon, реализованная по количеству используемых времен ТЕ, называется 2-точечный Dixon (англ. two-point). Такой подход оказывается крайне восприимчив к неоднородности постоянного магнитного поля B0, так как фазовые сдвиги, вследствие эффектов B0 и химического сдвига, оказываются неразличимы. Существенно снизить влияние неоднородности поля B0 удалось с внедрением методики 3-точечного Dixon (англ. 3-Point Dixon). При этом осуществляется сбор одного in-phase изображения и двух out-phase изображений. Любые фазовые изменения между out-phase изображениями являются следствием неоднородностей поля B0 и используются для корректировки получаемых изображений воды и жира [7]. Этот метод в настоящее время часто используется для быстрого получения изображений с жироподавлением. Методика mDixon может использоваться как с последовательностями градиентного, так и спинового эха и различными взвешенностями изображений. (дополнительно можно ознакомиться на страницах журнала Field Strength (“The next generation fat-free imaging”), (“Одна последовательность, множество преимуществ в МРТ опорно-двигательного аппарата”). Ускорение mDIXON возможно с помощью методов SENCE и Compressed SENCE. Несмотря на большие преимущества методики Dixon, такой подход к количественной обработке оказывается неэффективным для построения карт фракции жира. Основными ограничениями являются отсутствие учета T2* релаксации и состава жирового спектра. Так, при использовании 2- и 3- точечного Dixon учитывается только самый интенсивный сигнал от цепочки метиленовых –СH2- протонов (δ = 1.30 ppm) (рис. 2). В реальности присутствуют сигналы и других функциональных групп жира. Всего в таком спектре присутствует 7 сигналов жира (рис. 2.). Впервые учет вышеперечисленных факторов использовался в работе [8], став доступным с внедрением метода наименьших квадратов в модели, предполагающей несколько компонент жира. Коррекция на затухание Т2* позволяет получить значения фракции жира по протонной плотности (PDFF). Автоматическое построение PDFF карт с использованием 7-компартментной модели жира и коррекции на Т2* доступно с помощью методки mDixon Quant. Пример получаемой карты распределения жира в печени можно найти на рис. 5. В качестве общих рекомендаций к применению данной последовательности необходимо отметить следующие важные параметры: 1) использование малых времен повторения (TR = 5-10 мс) и углов опрокидывания (flip angle FA = 3-5°) для снижения эффектов Т1 релаксации; 2) оптимальное количество времен ТЕ – 6.
Клинические приложения измерения водно-жирового состава
Заболевания печени
Как уже отмечалось ранее, изменение водно-жирового состава непосредственно в органах и тканях может указывать на развитие патологических состояний. Наиболее часто значения фракции жира (измеренные с помощью Dixon и МР спектроскопии) используются в качестве биомаркера жирового гепатоза и ассоциирующимися с такими изменениями заболеваниями [2]. Жировая инфильтрация печени отождествляется с накоплением триглицеридов и других жиров в клетках печени, и является крайне распространенной патологией, особенно среди жителей развитых стран. Существует обширный ряд факторов риска развития жирового стеаноза – от принятия алкоголя и лекарственных препаратов до метаболических заболеваний [9]. Более того, существуют доказательства, утверждающие, что у пациентов с неалкогольной жировой болезнью существенно повышается риск развития диабета [10] и смертность из-за сердечно-сосудистых осложнений [11]. В ряде случаев жировая инфильтрация вызывает гибель гепатоцитов и прогрессирует в воспаление печени (стеатогепатит) с фиброзом, переходящим в цирроз. Большинство работ выявляют отличные соответствия между значениями PDFF, измеренными с помощью Dixon методик и МР спектроскопией [12], а также гистологическими исследованиями [13, 14]. Также выявлены достоверные показатели воспроизводимости значений PDFF, измеренных в различных клиниках с использованием МР сканеров разных производителей с различными напряженностями магнитного поля [15], что делает данные методики крайне полезными и информативными для ранней диагностики жировой инфильтрации печени [16].Е Жировой гепатоз - это потенциально обратимое состояние даже в тяжелых случаях, поэтому неинвазивная количественная оценка содержания жира может быть крайне важна при контроле эффективности проводимой терапии [17].
Заболевания скелета и костного мозга
Исследования жирового состава костного мозга, принимающего участие в процессах кроветворения и системного обмена веществ, являются второй по распространенности областью применения МР методов определения фракции жира. Так, ряд исследований продемонстрировали обратные зависимости между параметрами фракции жира и минеральной плотностью костей у пациентов с остеопорозом и остеопенией [18-19]. Аналогичный результат был получен в одном из совместных научных проектов Philips с НИИ Неотложной Детской Хирургии и Травматологии – чем выше содержание жира в позвонках у детей, тем ниже значения минеральной плотности. Более того, выявлено, что пациенты с более высокими значениями FF в большей степени подвержены риску травматизации при компрессионном переломе позвоночника [20]. Часть исследований утверждает, что жировые клетки участвуют в снижении костной массы за счет лептина, однако, более точные модели требуют дальнейших научно-клинических разработок. Помимо остеопороза и остеопении изменения в жировом составе костного мозга были выявлены у пациентов с диабетом [21]. Количественные значения PDFF могут использоваться как маркер относительного содержания красного и желтого костного мозга, которое может изменяться в случае злокачественной инфильтрации [22], а также заболеваний кроветворной системы. В одном из совместных с Philips научных проектов сотрудники отдела лучевой диагностики Национального Медицинского Исследовательского Центра Детской Гематологии, Онкологии и Иммунологии им. Дмитрия Рогачева обнаружили резкое снижение значений фракции жира у пациентов с острым лимфобластным лейкозом [23]. Дальнейшее изучение показателей PDFF в динамике химиотерапевтического лечения может позволить производить неинвазивную оценку эффективности проводимой терапии. Наряду с этим было обнаружено снижение значений PDFF в области острого воспалительного процесса у пациентов со спондилоартритом, для которых оценка воспалительного процесса является одной из первостепенных задач для наблюдения за развитием заболевания и эффективностью терапии. При этом, в хронической стадии значения фракции жира, наоборот, увеличиваются. Количественные методики оценки значений PDFF оказываются более воспроизводимыми, чем рутинные методы, основанные на визуальной оценке по Т1, Т2 иSTIR изображениям.
Другие заболевания
Методики визуализации Dixon формируют быстрый сбор данных, что в сочетании с ЭКГ синхронизацией позволяет осуществлять измерения соотношения жир - вода в сердечной мышце [2]. Так, выявленное увеличение жира было присуще как ишемической, так и неишемической кардиомиопатии, и связывалось с негативным исходом [24]. Однако прямой связи между содержанием жира и нарушениями функционирования миокарда до настоящего времени установлено не было. Существует теория, требующая доказательства дальнейшими клиническими исследованиями, что накопление жира в некоторых случаях может приводить к инфаркту миокарда, вероятнее всего, вследствие метаболических изменений, приводящих к слабой ишемии. Наконец, крайне перспективными измерения FF могут оказаться в случае нейро-мышечных заболеваний. К примеру, у пациентов с миотонической дистрофией была обнаружена явная связь между тяжестью заболевания и значениями FF, рассчитанными в мышечной ткани нижних конечностей [25]. Наряду со значениями FF, параметры Т2 жира и воды, которые могут быть посчитаны раздельно как с помощью методик CSE MRI, так и посредством МР – спектроскопии. Эти значения также могут быть важными диагностическими биомаркерами воспаления мышц, мышечной атрофии и жировой инфильтрации печени.
Статья подготовлена совместно с коллективом отделения лучевой диагностики Национального Медицинского Исследовательского Центра Детской Гематологии, Онкологии и Иммунологии им. Дмитрия Рогачева.
Связанные решения
-
mDIXON XD TSE - Головной мозг
mDIXON XD TSE — клиническое приложение для МР-томографии головного мозга, обеспечивающее однородное подавление сигнала от жировой ткани при стандартном времени сканирования. Технология генерирует до четырех типов контрастирования в рамках одного сканирования TSE, включая изображения с подавлением жира и без него. Применяется в нейрорадиологии для диагностики патологий головного мозга, заменяя стандартные протоколы TSE и упрощая рабочий процесс.
NMRB813 -
mDIXON XD FFE - Брюшная полость
Клиническое приложение mDIXON XD FFE для МР-томографов применяется в диагностике патологий органов брюшной полости. Технология обеспечивает подавление сигнала от жировой ткани без увеличения времени сканирования, что критично при обследовании пациентов с ограниченной способностью задерживать дыхание. За одно сканирование формируется до четырёх типов изображений, включая контрастирование с подавлением жира и без него, что исключает необходимость повторных процедур.
NMRB812 -
mDIXON Quant
Приложение mDIXON Quant обеспечивает быстрое и удобное выполнение неинвазивного количественного анализа жировой ткани печени в режиме 3D, предоставляя трехмерные карты жировой фракции всей печени высокого качества с высоким уровнем точности (±3,5%) и воспроизводимости (±1,4%)¹ даже при коротком T2*, позволяя расширить возможности МРТ. Для облегчения диагностики предоставляются карты релаксации T2*/R2*.
NMRB462
Список использованной литературы:
[1] Ren J. Journal of Lipid Research 49: 2055-2062 (2008) [2] Bray T. et al. Br J Radiol 2018; 90: 20170344. https://doi.org/10.1259/bjr.20170344 [3] Семенова Н. Успехи физиологических наук 2019, 50(1) 58-74 https://doi.org/10.1134/S0301179819010107 [4] Karampinos, D. et al. J. Magn. Reson. Imaging 47, 332–353 (2018). [5] Reeder S. B., Hines, C. D., Yu, H., Mckenzie, C. A. & Brittain, J. H. On The Definition of Fat-Fraction for In Vivo Fat Quantification with Magnetic Resonance Imaging. [6] Dixon T. Radiology 153: 189-194 (1984) doi: https://doi.org/10.1148/radiology.153.1.6089263 [7] Qing_San X. et al. JMRI 7:1002-1015 (1997) doi: https://doi.org/10.1002/jmri.1880070612 [8] Li A. et al. Magnetic Resonance in Medicine 46:126 –130 (2001) https://doi.org/10.1002/mrm.1167 [9] Т.Е. Полунина и др. "ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Гастроэнтерология" №3 [10] Ekstedt M. et al Hepatology. 2006 Oct;44(4):865–873. [11] Schindhelm R. et al. Curr Diab Rep. 2007 Jun;7(3):181–187. [12] Heba E. et al J Magn Reson Imaging 2016; 43: 398–406. doi: https://doi.org/10.1002/jmri.25006 [13] Idilman I. et al. Abdom Imaging 2015; 40: 1512–9. doi: https://doi.org/10.1007/s00261-015-0385-0 [14] Park C et al. Gastroenterology 2017; 152: 598–607. doi: https://doi.org/10.1053/j.gastro.2016.10.026 [15] Hernando D et al. Magn Reson Med 2017; 77: 1516–24. doi: https://doi.org/10.1002/mrm.26228 [16] Zhan C. Et al. Abdom Radiol 44, 3040–3048 (2019). https://doi.org/10.1007/s00261-019-02118-9 [17] Ozaki A. et al. Contemp Clin Trials Commun. 17 (2020): 100516. doi: 10.1016/j.conctc.2019.100516 [18] Wren T. et al. J Clin Endocrinol Metab 2011; 96: 782–6. doi: https://doi.org/10.1210/jc.2010-192293. [19] Shen W. et al. Radiology 2005; 236: 945–51. doi: https://doi.org/10.1148/radiol.2363041425 [20] Menshchikov P. et al. IOP Conf. Series: Journal of Physics: Conf. Series, 2020, 1461, 012098. https://doi.org/10.1088/1742-6596/1461/1/012098 [21] Baum T et al. J Magn Reson Imaging 2012; 35: 117–24. doi: https://doi.org/10.1002/jmri.22757109 [22] Takasu M et al. PLoS One 2015; 10: e0116842: .doi: https://doi.org/10.1371/journal.pone.0116842 [23] Терещенко Г. Оценка костного мозга при лейкемии РОРР 2018 [24] Kellman P. Curr Cardiovasc Imaging Rep 2010; 3: 83–91. doi: https://doi.org/10.1007/s12410-010-9012-1 [25] Hiba B. et al. J Magn Reson Imaging 2012; 35: 678–85. doi: https://doi.org/10.1002/jmri.22849